Внутрішня енергія макроскопічного тіла визначається характером руху та взаємодії всіх мікрочастинок, з яких складається тіло (система тіл). Таким чином, до внутрішньої енергії слід віднести:
- кінетичну енергію хаотичного (теплового) руху частинок речовини
(атомів, молекул, йонів); - потенціальну енергію взаємодії частинок речовини;енергію взаємодії атомів у молекулах (хімічну енергію);
- енергію взаємодії електронів і ядра в атомі (внутрішньоатомну енергію);
- енергію взаємодії нуклонів у ядрі (внутрішньоядерну енергію).
Однак для описування теплових процесів є важливим не стільки значення внутрішньої енергії, як її зміна. У ході теплових процесів хімічна енергія, а також внутрішньоатомна і внутрішньоядерна енергії практично не змінюються. Саме тому внутрішня енергія в термодинаміці визначається як сума кінетичних енергій хаотичного (теплового) руху частинок речовини (атомів, молекул, йонів), з яких складається тіло, і потенціальних енергій їх взаємодії.
Внутрішню енергію позначають символом \(U\). Одиниця внутрішньої енергії в СІ — джоуль: [\(U\)]=1 \(Дж\) (J).
Особливості внутрішньої енергії ідеального газу:
- Атоми і молекули ідеального газу практично не взаємодіють між собою, тому внутрішня енергія ідеального газу дорівнює кінетичній енергії поступального та обертального рухів його частинок.
- Внутрішня енергія даної маси ідеального газу прямо пропорційна його абсолютній температурі.
- Внутрішня енергія — функція стану системи, тобто вона однозначно визначається основними макроскопічними параметрами (p, V, T), що характеризують систему, і незалежно від того, яким чином систему переведено з одного стану в інший, зміна внутрішньої енергії буде однаковою.
- Внутрішню енергію можна змінити двома способами: виконанням роботи і теплопередачею
Доведемо останнє твердження для одноатомного газу. Атоми такого газу рухаються тільки поступально, тому, щоб визначити його внутрішню енергію, слід середню кінетичну енергію поступального руху атомів помножити на кількість атомів:
\(=\)
\(=\)
= \(U\)
Розпишемо кількість атомів через кількість речовини і отримаємо кінцеву формулу:
Згадаємо рівняння Менделєєва — Клапейрона і виведемо ще одну корисну формулу:
Теплопередача (теплообмін) — процес зміни внутрішньої енергії тіла або частин тіла без виконання роботи.
Процес теплопередачі можливий тільки в разі наявності різниці температур. Довільно внутрішня енергія завжди передається від більш нагрітого тіла до менш нагрітого. Чим більша різниця температур, тим швидше(за інших рівних умов) відбувається процес передачі тепла. Існують \(3\) основних види теплопередачі:
Процес теплопередачі можливий тільки в разі наявності різниці температур. Довільно внутрішня енергія завжди передається від більш нагрітого тіла до менш нагрітого. Чим більша різниця температур, тим швидше(за інших рівних умов) відбувається процес передачі тепла. Існують \(3\) основних види теплопередачі:
- Теплопровідність. Вид теплопередачі, який зумовлений хаотичним рухом частинок речовини та не супроводжується перенесенням цієї речовини. Найкращими провідниками тепла є метали, погано проводять тепло дерево, скло, шкіра, рідини (крім рідких металів); найгірші провідники тепла — гази. Передача енергії від гарячої води до батареї опалення, від поверхні води до її нижніх шарів тощо відбувається завдяки теплопровідності.

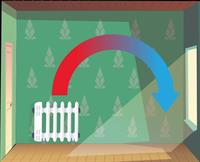
- Конвекція. Вид теплопередачі, за якого тепло переноситься потоками рідини або газу. Теплі потоки рідини або газу мають меншу густину, тому під дією архімедової сили піднімаються, а холодні потоки — опускаються. Завдяки конвекції здійснюється циркуляція повітря в приміщенні, нагрівається рідина в каструлі, що стоїть на плиті, існують вітри і морські течії та ін. У твердих тілах конвекція неможлива.
- Випромінювання. Вид теплопередачі, за якого енергія передається за допомогою електромагнітних хвиль. Найуніверсальніший вид теплопередачі: тіла завжди випромінюють і поглинають інфрачервоні (теплові) електромагнітні хвилі. Це єдиний вид теплообміну, який можливий у вакуумі (енергія від Сонця передається тільки випромінюванням). Краще випромінюють і поглинають енергію тіла з темною поверхнею.

Кількість теплоти Q — це фізична величина, що дорівнює енергії, яку тіло одержує (або віддає) в ході теплопередачі. Одиниця кількості теплоти в СІ — джоуль: [ ] Q =\(1\) \(Дж\) (J).
Із курсу фізики \(8\) класу ти знаєш, що кількість теплоти, яка поглинається при нагріванні речовини (або виділяється при її охолодженні), обчислюють за формулою: , де \(c\) — питома теплоємність речовини; \(m\) — маса речовини; — зміна температури.
Добуток питомої теплоємності і маси речовини, з якої виготовлено тіло, називають теплоємністю тіла: .
| Розрахунок кількості теплоти в разі фазових переходів | |
| Кристалічний стан ↔ Рідкий стан | Рідкий стан ↔ Газоподібний стан |
| Температуру, за якої відбуваються фазові переходи «кристал → рідина» і «рідина → кристал», називають температурою плавлення — вона залежить від роду речовини і зовнішнього тиску. Кількість теплоти Q, яка поглинається при плавленні кристалічної речовини (або виділяється при кристалізації рідини), обчислюють за формулою:, де \(m\) — маса речовини; \(λ\) — питома теплота плавлення. |
Фазові переходи «рідина → пара» і «пара → рідина» відбуваються за будьякої температури. Кількість теплоти Q, яка поглинається при пароутворенні (або виділяється при конденсації), обчислюють за формулою:, де \(m\) — маса речовини; \(r\) — питома теплота пароутворення за даної температури (зазвичай у таблицях подають питому теплоту пароутворення за температури кипіння рідини). |
| Нагадаємо: і під час плавлення, і під час кипіння температура кристалічних речовин не змінюється. | |