Усі метали мають подібні властивості: у них характерний металічний блиск, висока ковкість, гарна електропровідність і теплопровідність.

Алюміній

Золото
Ці властивості металів обумовлені наявністю у них особливого виду хімічного зв'язку — металічного зв'язку.
Особливість атомів металічних елементів — невелике число електронів на зовнішньому рівні і порівняно великі радіуси. Тому атоми металічних елементів на відміну від атомів неметалічних елементів легко віддають зовнішні електрони і перетворюються на позитивні йони:
.
Електрони, що відірвалися від атомів, переміщаються від одного йона до іншого. Сполучаючись з йонами, електрони тимчасово перетворюють їх на атоми:
.
Потім електрони знову відриваються і приєднуються до інших йонів і так далі.
Ці процеси відбуваються нескінченно, що можна виразити загальною схемою:
Ці процеси відбуваються нескінченно, що можна виразити загальною схемою:
.
Між електронами і позитивними йонами виникає електростатична взаємодія. Негативні електрони утримують шари позитивних йонів.
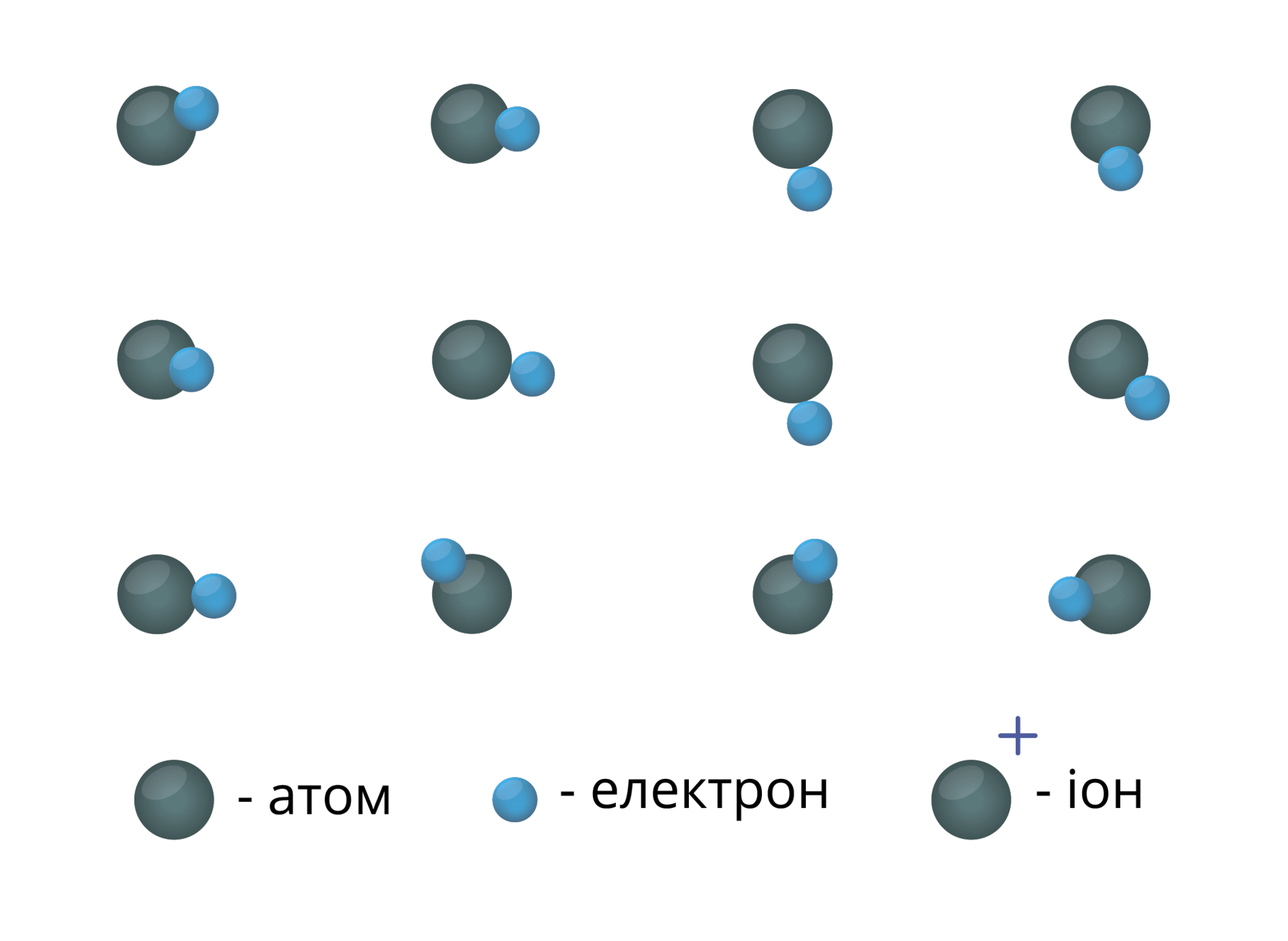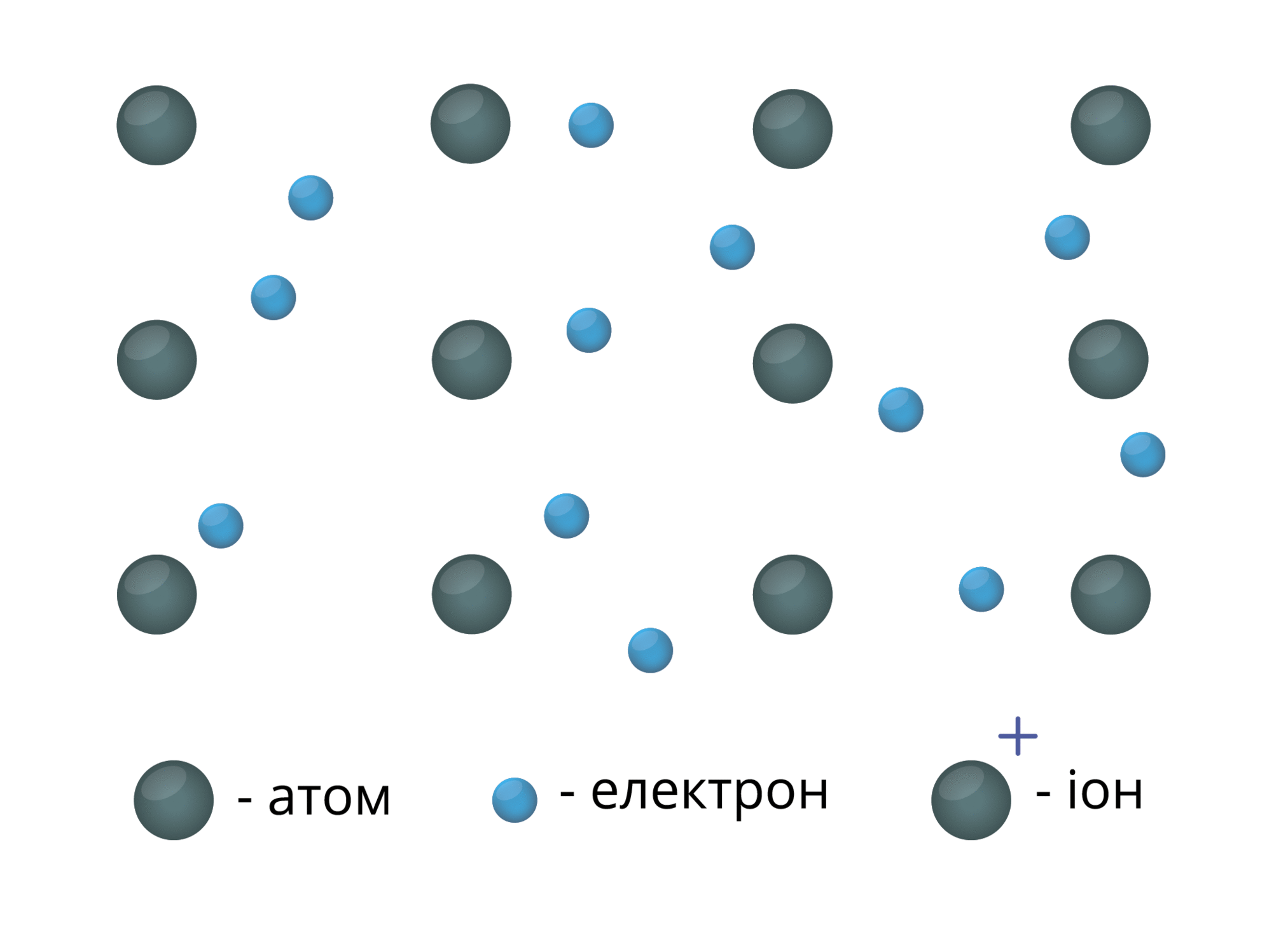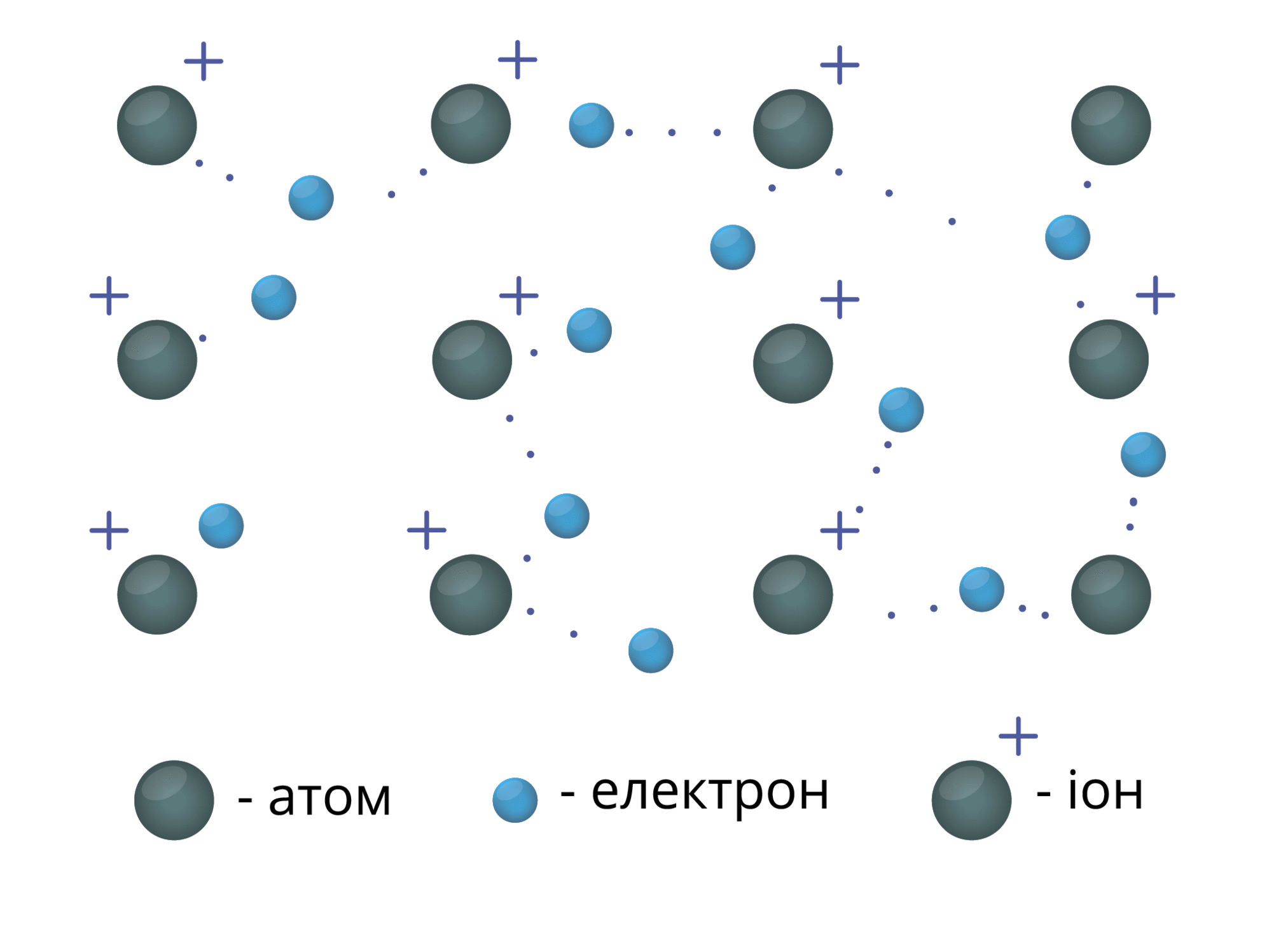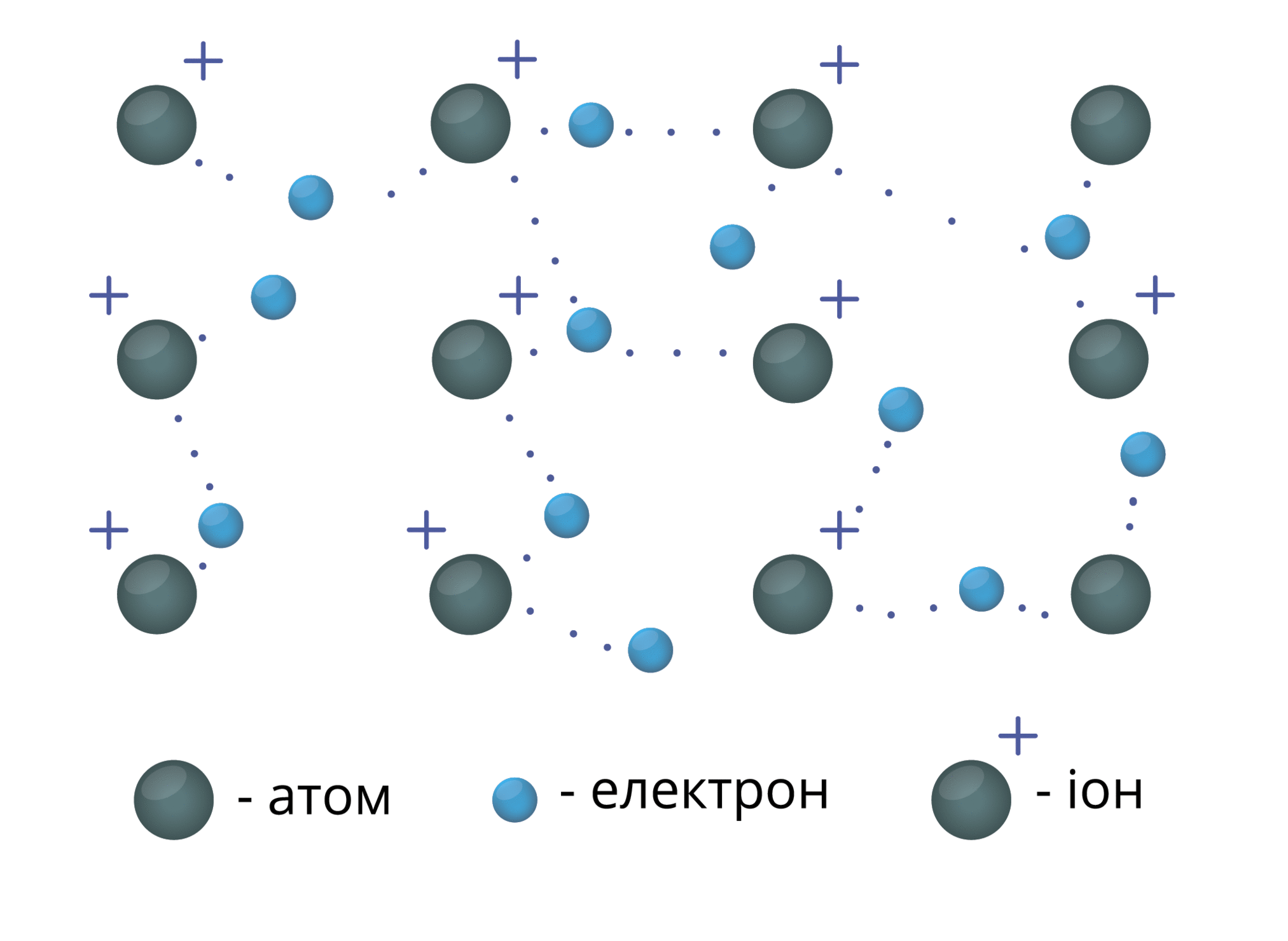
Металічний зв'язок — це зв'язок між позитивними йонами і атомами металічних елементів за допомогою узагальнених електронів.
Кристал металу можно уявити як велику кількість катіонів, занурених у «море» вільних електронів.
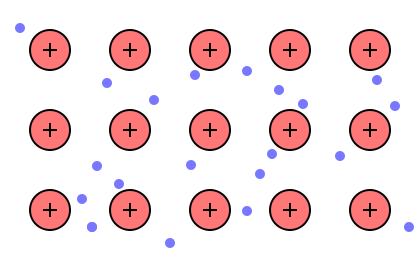
Завдяки вільним електронам метали добре проводять тепло і електричний струм, мають характерний блиск і ковкість.
Число зовнішніх електронів у атомів металічних елементів є різним. Воно дорівнює номеру групи Періодичної системи, в якій міститься металічний елемент. Так, у атомів лужних металів є один електрон, який здатний відриватися від атома, а в атомів Алюмінію таких електронів — три:
;
.
Металічний зв'язок є характерним для чистих металів і для сумішей різних металів — сплавів (бронза, сталь, чавун, латунь, тощо), якщо вони знаходяться у твердому або рідкому стані.

Сталь

Латунь
