Уявімо, що зустрілися два атоми: атом лужного металу і атом галогену. В атомі металу на зовнішньому енергетичному рівні — один електрон, а в атомі неметалу якраз не вистачає одного електрона, щоб завершити свій зовнішній рівень.
Атом металу легко віддасть свій слабо зв'язаний з ядром валентний електрон атому неметалу, який надасть йому вільне місце на зовнішньому енергетичному рівні. Обидва в результаті отримають заповнені зовнішні рівні.
Атом металу при цьому отримає позитивний заряд, а атом галогену перетвориться в негативно заряджену частинку. Такі частинки називаються йонами.
Йони — заряджені частинки, в які перетворюються атоми, коли вони приєднують або віддають електрони.
Протилежно зарядженні йони, що утворилися, притягуються один до одного, утворюючи хімічний зв'язок, який називається йонним.
Йонний зв'язок — зв'язок між позитивно і негативно зарядженими йонами.
Розглянемо механізм утворення йонного зв'язку на прикладі взаємодії атомів Натрію і Хлору.
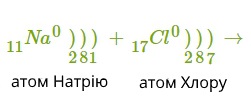
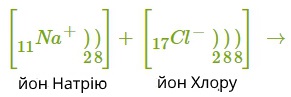

Позитивно заряджений йон називається катіон.
Негативно заряджений йон називається аніон.
Таке перетворення атомів на йони відбувається завжди при взаємодії атомів типових металів і типових неметалів, електронегативності яких суттєво відрізняються.
Йонний зв'язок утворюється в складних речовинах, що складаються з атомів металів і неметалів.
Приклад:
Взаємодія Кальція і Флуора
1. Кальцій — елемент головної підгрупи другої групи. Йому легше віддати два зовнішніх електрони, ніж прийняти шість електронів, яких не вистачає до завершення зовнішнього рівня.

2. Флуор — елемент головної підгрупи сьомої групи. Йому легше прийняти один електрон, ніж віддати сім.
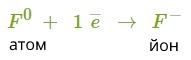
3. Знайдемо найменше спільне кратне між зарядами йонів, що утворюються. Воно дорівнює \(2\). Визначимо число атомів Флуору, які приймуть два електрони від атома Кальцію: \(2\) \(:\) \(1\) \(=\) \(2\).
4. Складемо схему утворення йонного зв'язку:
.
Приклад:
Взаємодія Натрію і Оксигену
1. Натрій — елемент головної підгрупи першої групи. Він легко віддає один зовнішній електрон.

2. Оксиген — елемент головної підгрупи шостої групи. Йому легше прийняти два електрони, ніж віддати шість.
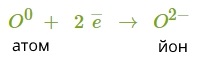
3. Знайдемо найменше спільне кратне між зарядами йонів, що утворюються. Воно дорівнює \(2\) \(:\) \(1\) \(=\) \(2\). Визначимо число атомів Натрію, які віддадуть два електрони атому Оксигену: \(2\).
4. Складемо схему утворення йонного зв'язку:
.
За допомогою йонного зв'язку утворюються також сполуки, в яких є складні йони:
.
Отже, йонний зв'язок існує в солях і основах.
Зверни увагу!
Солі амонію не містять металу, але утворенні за допомогою йонного зв'язку.
Йони створюють навколо себе електричне поле, що діє у всіх напрямках. Тому кожен йон оточують йони протилежного знаку. Така сполука являє собою величезну групу позитивних і негативних частинок, розташованих у певному порядку.
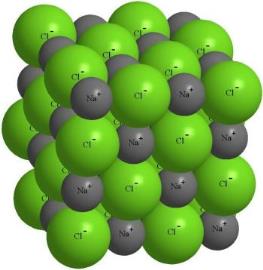
Притягування між йонами є досить сильним, тому йонні речовини мають високі температури кипіння і плавлення.
Зверни увагу!
Усі йонні сполуки за нормальних умов — тверді речовини.
Приклади речовин з йонним зв'язком:

Питна сода

Залізний купорос

Кухонна сіль
