Будова молекули
Формула амоніаку (амоняку, аміаку) — . Ступінь окиснення Нітрогену становить \(–3\). У молекулі три ковалентні полярні зв'язки. У атому Нітрогену одна електронна пара залишається неподіленою і грає важливу роль в здатності амоніаку вступати у хімічні реакції.
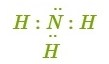
Молекула аміаку має форму піраміди, у вершині якої розташован атом Нітрогену, а у основі — три атоми Гідрогену.
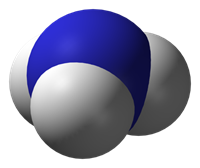
Загальні електронні пари в молекулі зміщені до більш електронегативного атому Нітрогену. Він заряджений негативно, а атоми Гідрогену — позитивно. Тому молекула полярна і являє собою диполь. Завдяки високій полярності молекули амоніаку здатні утворювати водневі зв'язки між собою і з молекулами води. Утворення водневих зв'язків впливає на фізичні властивості речовини.
Фізичні властивості
При нормальних умовах амоніак являє собою безбарвний газ з різким неприємним запахом. Він легший за повітря. Отруйний.
Амоніак дуже добре розчиняється у воді — при \(20\) °С в одному об'ємі води може розчинитися до \(700\) об'ємів амоніаку. Розчин із вмістом газу \(25\) % називається аміачною водою, а \(10\) % розчин використовується у медицині як нашатирний спирт.
Амоніак легко зріджується при низькій температурі або при підвищеному тиску. При випаровуванні рідкого амоніаку поглинається багато тепла, що дозволяє використовувати його у холодильних установках.
Хімічні властивості
1. Відновні властивості.
Ступінь окиснення Нітрогену в амоніаку — \(–\)\(3\), тому в окисно-відновних реакціях він виступає в ролі сильного відновника.
Амоніак окиснюється киснем з утворенням азоту або нітроген(\(II\)) оксиду. Результат реакції залежить від умов її протікання.
При горінні амоніаку в чистому кисні утворюється азот:
.
Якщо реакція проводиться з каталізатором, то утворюється нітроген(\(II\)) оксид:
.
2. Основні властивості.
Якщо у водний розчин амоніаку додати декілька крапель фенолфталеїну, то його забарвлення стане малиновим. Отже, розчин містить гідроксид-йони. Утворення цих йонів відбувається у результаті реакції між водою і молекулами амоніаку:
Утворений у реакції нестійкий амоній гідрат частково дисоціює на йони амонію і гідроксид-йони.
Амоніак реагує з кислотами. При цьому утворюються солі амонію. Так, з хлоридною кислотою утворюється амоній хлорид, а з сульфатною — амоній сульфат:
,
..
Отримання і застосування
У промисловості амоніак синтезують з азоту і водню:
.

Виробництво амоніаку
Лабораторний спосіб отримання — реакція між сіллю амонію і кальцій гідроксидом:
.
У великих кількостях амоніак застосовується для виробництва нітратної кислоти і мінеральних добрив, а також барвників і вибухових речовин. Використовується в холодильних установках. Нашатирний спирт застосовується у медицині і у побуті.