Хімічний елемент
Сульфур — хімічний елемент № \(16\). Він розташован у VIА групі третьому періоді Періодичної системи.
На зовнішньому шарі атома Сульфуру містяться шість валентних електронів. До завершення зовнішнього шару не вистачає двох електронів. Тому у сполуках з металами і Гідрогеном Сульфур виявляє ступінь окиснення \(-2\). При взаємодії з більш елетронегативними елементами (Оксигеном, галогенами) Сульфур утворює сполуки, в яких його ступінь окиснення є позитивним (\(+4\) або \(+6\)).
У земній корі сірка зустрічається у самородному вигляді або у вигляді мінералів і гірських порід: (пірит — , цинкова обманка — , свинцевий блиск — , гіпс — , глауберова сіль — ).

Самородна сірка

Свинцевий блиск
Сульфур належить до макроелементів живих організмів. Він міститься у білках. Особливо багато Сульфуру у білках волосся, рогів, вовни. Входить він також до складу деяких вітамінів і гормонів.
Проста речовина
Сульфур утворює кілька алотропних модифікацій. Зазвичай ми маємо справу з кристалічною сіркою, яка складається з восьмиатомних циклічних молекул.
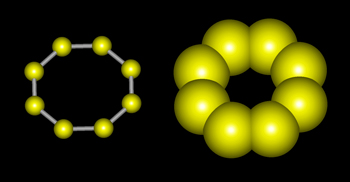
Молекули утворюють кристали різної будови, і тому існують алотропні видозміни: ромбічна і моноклінна сірка. Обидві модифікації являють собою жовті легкоплавкі речовини. Температури плавлення їх не є однаковими (\(+112,8\) °С і \(+119,3\) °С).

При нагріванні сірка плавиться, перетворюється в легку рідину, а потім починає темніти і ставати в'язкою. Утворюється пластичнасірка, що складається з довгих лінійних молекул.
У воді сірка не розчиняється і нею не змочується. Тому порошок сірки не тоне у воді, не дивлячись на більшу густину (\(2,07\) г / см³). Таке явище називається флотацією.
Підпалена сірка реагує з киснем, і утворюється сірчистий газ. Сірка у цій реакції — відновник.
.
Окисні властивості сірка виявляє в реакціях з металами і воднем.
З активними металами і ртуттю реагує при кімнатній температурі:
.
При нагріванні сірка вступає в реакцію з більшістю металів — залізом, алюмінієм, цинком та іншими, крім золота і платини.
.
У реакціях з металами утворюються сульфіди.
При підвищеній температурі сірка реагує з воднем. утворюється гідроген сульфід:
.
Використання сірки
- Використовується в хімічній промисловості для виробництва сульфатної кислоти;
- застосовується у сільському господарстві для знезараження приміщень;
- входить до складу деяких мазей;
- використовується у виробництві сірників і паперу;
- за її допомогою каучук перетворюють у гуму;
- входить до складу вибухових речовин.