Одною з найважливіших характеристик електрона є його енергія.
Величина енергії залежить від того, на якій відстані від ядра рухається електрон. Найменшу енергію має електрон, який розташовується найближче до ядра атома. По мірі віддалення від ядра енергія електрона збільшується.
Віддаль від ядра, на якій є найбільш імовірне перебування електрона, називають енергетичним рівнем.
Кількість енергетичних рівнів в електронній оболонці атома визначають за номером періоду, в якому міститься елемент.
Наприклад, Карбон — елемент \(2\) періоду, тому електрони в атомі цього елемента розташовуються на двох енергетичних рівнях. Кальцій — елемент \(4\) періоду, отже електрони в атомі цього елемента розташовані на чотирьох енергетичних рівнях.
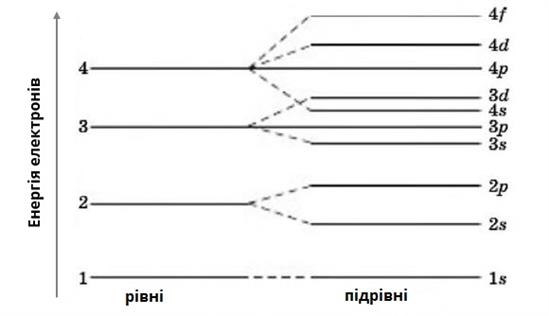
Енергетичні рівні складаються з підрівнів, причому номер рівня вказує на кількість підрівнів. Наприклад, у першого рівня є один підрівень, у другого — два підрівня, у третього — три і т.д.
Розподіл електронів за енергетичними рівнями
Енергетичні рівні нумерують, починаючи з найближчого до ядра.
Встановлено, що максимальне число електронів на енергетичному рівні дорівнює \(2n²\), де \(n\) — його номер.
Отже, на першому рівні може перебувати не більше \(2\) електронів, на другому — не більше \(8\), на третьому — не більше \(18\), тощо.
На першому енергетичному рівні містяться лише \(s\)-електрони. На другому енергетичному рівні — \(s-\) і \(p-\)електрони. На третьому енергетичному рівні — \(s-\), \(p-\) і \(d-\)електрони. На четвертому і наступних енергетичних рівнях — \(s-\), \(p-\), \(d-\) і \(f-\)електрони.
