Запропонована Е. Резерфордом у \(1911\) році ядерна (планетарна) модель будови атома зводиться до наступних положень:
• атом складається з позитивно зарядженого ядра і електронів, що рухаються навколо нього;
• більше \(99,96\) % маси атома зосереджена в його ядрі;
• діаметр ядра приблизно в сто тисяч разів менше діаметра самого атома.
Відповідно до цієї моделі можна дати наступне визначення атома:
Атом — електронейтральна частинка, що складається з позитивно зарядженого ядра і негативно заряджених електронів.
Ядро атома складається з елементарних частинок: протонів і нейтронів. Протони і нейтрони мають загальну назву нуклони (ядерні частинки).
Протон (\(p\)) — частинка, яка має заряд \(+1\) і відносну масу, що дорівнює \(1\).
Нейтрон (\(n\)) — частинка без заряду і відносною масою \(1\).
До елементарних частинок належать також електрони (), які утворюють електронну оболонку атома.
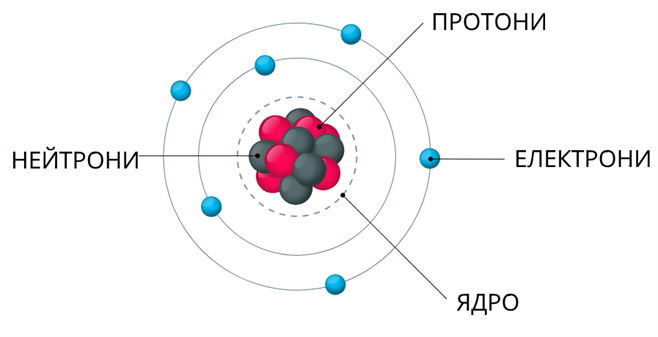
Протони і нейтрони мають однакову масу. Маса електрона складає маси протона і нейтрона. Тому основна маса атома зосереджена в його ядрі.
Протон має позитивний заряд \(+1\). Заряд електрона — негативний і по величині дорівнює заряду протона \(–\)\(1\).
Частинки | Відносна маса | Відносний заряд |
| Протон | 1 | +1 |
| Нейтрон | 1 | 0 |
| Електрон | 1/1840 | –1 |
Встановлено, що число протонів в ядрі дорівнює порядковому номеру елемента в періодичній таблиці.
Заряд ядра визначається числом протонів в ньому. Отже, заряд ядра теж дорівнює порядковому номеру елемента.
Атом — електронейтральна частинка, тому число електронів в ньому дорівнює числу протонів.
Зверни увагу!
Порядковий номер элемента \(=\) заряду ядра атома \(=\) числу протонів у ядрі \(=\) числу електронів в атомі.
Гідроген — елемент № \(1\). Заряд ядра його атома дорівнює \(+1\). В ядрі знаходиться один протон, а в електронній оболонці — один електрон.
Карбон — елемент № \(6\). Заряд ядра його атома дорівнює \(+6\), у ньому — \(6\) протонів. В атомі міститься \(6\) електронів з загальним зарядом \(–\)\(6\).
Зверни увагу!
Заряд ядра — головна характеристика атома.
Вивчення будови атомних ядер привело до уточнення формулювання періодичного закону. Сучасне формулювання звучить наступним чином:
Властивості хімічних елементів і утворених ними простих і складних речовин перебувають у періодичній залежності від величин зарядів ядер їх атомів.
Ми знаємо, що маса атома визначається масою ядра. Ядро складається з протонів і нейтронів, відносні маси яких дорівнюють \(1\). Маса ядра дорівнює сумі мас протонів і нейтронів. Число протонів визначаємо за порядковим номером елемента.
Число нейтронів в ядрі можна знайти, якщо від відносної атомної маси відняти
порядковий номер елемента.
Приклад:
Флуор — елемент № \(9\). Його відносна атомна маса дорівнює \(19\).
В ядрі атома Флуору — \(9\) протонів і \(19\) \(–\) \(9\) \(=\) \(10\) нейтронів.
Рубідій — елемент № \(37\). Його відносна атомна маса дорівнює \(85\).
В ядрі атома Рубідію — \(37\) протонів і \(85\) \(–\) \(37\) \(=\) \(48\) нейтронів.
