Стан атома, коли його електронні конфігурації мають мінімальну енергію, називають основним.
При отриманні атомом енергії ззовні (нагрівання, опромінення, тощо) електрони можуть переходити на вищі, вільні енергетичні орбіталі. Атом переходить у збуджений стан. Якщо відбувається перехід одного електрона — це перший збуджений стан. Двох — другий збуджений стан і т.д.
Наприклад, утворення першого збудженого стану атомів Карбону:
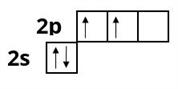
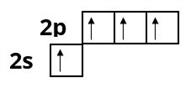
Збуджений стан атома позначають зірочкою вгорі після символу хімічного елемента — .
Валентні стани елементів та їхні ступені окиснення зв'язані між собою.
Атоми металічних елементів мають на зовнішньому енергетичному рівні невелику кількість електронів (зазвичай — \(1\) - \(3\).) Тому вони здатні віддавати їх, переходячи у збуджений стан і перетворюючись на позитивно заряджені йони — катіони:
.
Атоми неметалічних елементів на зовнішньому енергетичному рівні, як правило, мають від \(4\) до \(7\) електронів. Для завершення зовнішнього енергетичного рівня (що є енергетично вигідним для атома), йому не вистачає невеликої кількості електронів, які він і приєднує, перетворюючись на негативно заряджені йони — аніони:
.
Валентні стани елементів зумовлені особливостями будови зовнішнього енергетичного рівня атома хімічного елемента.
Валентність елементів можна передбачити за кількістю неспарених електронів у основному або збудженому стані.
Приклад:
атом Натрію має один неспарений електрон, тому він буде проявляти валентність \(І\), атом Оксигену має два неспарені електрони, і проявляє валентність \(ІІ\). Внаслідок переходу у збуджений стан у атома змінюється число неспарених електронів, тому деякі атоми проявляють змінну валентність.
