Ковалентний зв'язок — це зв'язок між атомами неметалів, який утворюється за рахунок спільних електронних пар.
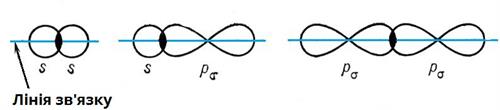
Зв'язок між двома атомами, спрямований вздовж прямої, яка сполучає їх ядра і співпадає з віссю симетрії електронних хмар, називається — зв'язком.
Відстань між центрами сполучених атомів називають довжиною ковалентного зв'язку.
Довжина одинарного зв'язку становить \(0,154\) нм.
При утворенні — зв'язку утворюються дві спільні ділянки орбіталей, які розміщуються симетрично по різні сторони від лінії сполучення центрів атомів:
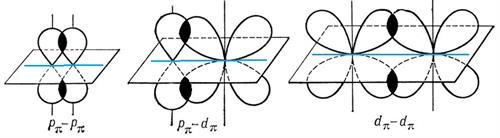
Простий (одинарний) зв'язок завжди є — зв'язком. Подвійний зв'язок між атомами Карбону складається з одного — зв'язку і одного — зв'язку. Потрійний зв'язок між атомами Карбону складається з одного — зв'язку та двох — зв'язків.
Довжина подвійного зв'язку дорівнює \(0,134\) нм, потрійного — \(0,120\) нм.
— зв'язок є міцнішим за — зв'язок.
Гібридизація — процес вирівнювання орбіталей за формою та розміщенням у просторі.
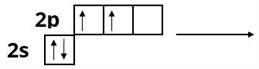
Електронна формула атома Карбону — . Під час утворення хімічного зв'язку один з електронів переходить на вакантну орбіталь:
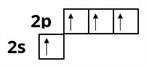
В утворенні молекули метану у процесі гібридизації беруть участь одна та три орбіталі. У результаті утворюються чотири однакові гібридні орбіталі. Отже у молекулі метану атом Карбону перебуває у стані гібридизації. орбіталь має форму об'ємної несиметричної вісімки, одна частина якої сильно витягнута по один бік від ядра атома. У просторі орбіталі розміщені під кутом одна відносно іншої.
У молекулі етену між атомами Карбону — подвійний зв'язок (один — та один зв'язок). Атоми Карбону перебувають у стані гібридизації. У гібридизації беруть участь одна та дві орбіталі, внаслідок чого утворюються три гібридні орбіталі, які мають форму несиметричних вісімок, витягнутих з одного боку, і розміщенні в одній площині під кутом одна до одної.
Атоми Карбону у молекулі етину перебувають у стані гібридизації.