Бензен є стійким проти дії окисників. Подібно до насичених вуглеводнів, він не змінює забарвлення розчину калій перманганату та не знебарвлює бромну воду.
Реакції заміщення
На відміну від ненасичених вуглеводнів, для бензену характерні реакції заміщення.Реакції галогенування.
Бензен вступає в реакцію з хлором (або бромом) у присутності каталізатора (хлоридів або бромідів Феруму(\(III\)) або Алюмінію). При цьому утворюються хлоробензен і гідроген хлорид:
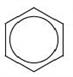
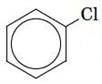 ;
; або:
.
У молекулі бензену усі атоми Гідрогену можна замінити на атоми Хлору:
.
Гексахлоробензен — безбарвна кристалічна речовина, яка використовується для протруювання насіння зернових проти шкідників.
Бензен взаємодіє з нітратною кислотою (у присутності сульфатної кислоти), утворюючи нітробензен:

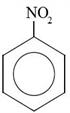 ;
;або:
.
Реакції приєднання
Бензен вступає у реакції приєднання, але важче ніж алкени чи алкіни.
Реакція гідрування відбувається під час нагрівання у присутності нікелевого
каталізатора. Внаслідок реакції утворюється циклогексан:

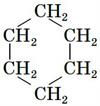 ;
;або:
.
При сильному освітленні бензен може приєднувати хлор — реакція приєднання галогенів. У результаті реакції утворюється \(1\), \(2\), \(3\), \(4\), \(5\), \(6\) — гексахлороциклогексан (гексахлоран):

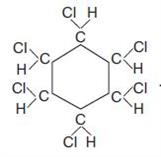 ;
;або:
Як і всі вуглеводні, бензен горить на повітрі:
.
