Найважливішими характеристиками ковалентного зв'язку є довжина, полярність і міцність. Ці характеристики визначають фізичні та хімічні властивості речовини: їх температури плавлення і кипіння, розчинність, хімічну активність.
Довжина ковалентного зв'язку — це відстань між ядрами сполучених атомів.
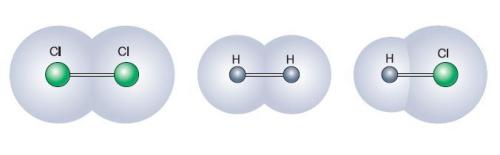
Довжина хімічного зв'язку залежить від радіусів атомів.
Чим більше радіуси атомів, тим довший зв'язок між ними.
— \(0,074\) нм;
— \(0,142\) нм;
— \(0,198\) нм;
— \(0,228\) нм;
— \(0,267\) нм.
Кратність зв'язку також впливає на її довжину.
Чим більше спільних електронних пар у атомів, тим коротшим є зв'язок.
— \(0,154\) нм;
— \(0,133\) нм;
— \(0,120\) нм.
Міцність ковалентного зв'язку — стійкість спільної електронної пари до розриву.
Міцність зв'язку визначає хімічну активність речовини: чим менше міцність зв'язку, тим легше речовина вступає в хімічні реакції.
Міцність зв'язку залежить від її довжини і кратності.
Чим менше довжина зв'язку, тим він міцніший.
В ряду сполук Гідрогену з галогенами
довжина зв'язку зростає, а міцність зменшується.
Чим більша кратність зв'язку, тим вище його міцність.
Приклад:
Молекули фтору і азоту відрізняються кратністю зв'язку: . Щоб розділити молекулу азоту на атоми, необхідно затратити приблизно у сім разів більше енергії, ніж для розриву зв'язку в молекулі фтору.
Полярність ковалентного зв'язку — значення часткових зарядів на зв'язаних атомах.
Полярність ковалентного зв'язку залежить від різниці електронегативності цих атомів.
Чим сильніше відрізняються атоми за електронегативністю, тим більше полярність зв'язку.
Приклад:
Полярність зв'язку зменшується, що узгоджується з положенням атомів у ряду електронегативності.
