Хімічний елемент
Карбон — хімічний елемент № \(6\). Він розташований у IVА групі Періодичної системи.
.
На зовнішньому шарі атома Карбону містяться чотири валентних електрони, і до його завершення не вистачає чотирьох електронів. Тому в сполуках з металами для Карбона характерна ступінь окиснення \(-4\), а при взаємодії з більш електронегативними неметаллами він проявляє позитивні ступені окиснення: \(+2\) або \(+4\).
У природі Карбон зустрічається як у вигляді простих речовин, так і у вигляді сполук. У повітрі міститься вуглекислий газ \(CO_2\). У земній корі поширені карбонати(наприклад, \(CaCO_3\) утворює крейду, мармур, вапняк). Горючі копалини (вугілля, торф, нафта, природний газ) складаються з органічних сполук, головним елементом яких є Карбон.
Карбон належить до життєво важливих елементів, оскільки входить до складу молекул усіх органічних речовин.
Прості речовини
Карбон утворює декілька алотропних видозмін, з яких найбільш відомими є алмаз і графіт.
Алмаз має атомну кристалічну ґратку. Кожен атом Карбону в алмазі зв'язаний чотирма міцними ковалентними зв'язками з сусідніми атомами, розташованими у вершинах тетраедра.
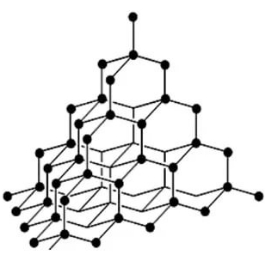
Завдяки такій будові алмаз — найтвердіша з усіх відомих природних речовин. Усі чотири валентних електрони кожного атома Карбону беруть участь в утворенні зв'язків, тому алмаз не проводить електричний струм. Це безбарвна прозора кристалічна речовина, добре заломлює світло.

Графіт теж має атомну кристалічну ґратку, але ґратка графіту є шаруватою. Кожен атом Карбону сполучений міцними ковалентними зв'язками з трьома сусідніми атомами. Утворюються плоскі шари з шестикутників, які між собою слабо зв'язані. Один валентний електрон у атома Карбону залишається вільним.
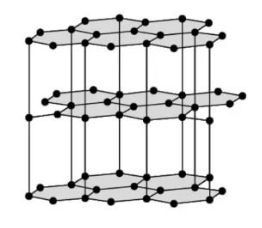
Графіт є темно-сірою речовиною з металічним блиском, жирний на дотик. На відміну від алмазу, графіт непрозорий, проводить електричний струм і залишає сірий слід на папері. Графіт має дуже високу температуру плавлення (\(3700\) °С).

Алмаз і графіт можуть взаємоперетворюватися. При сильному нагріванні без доступу повітря алмаз чорніє і перетворюється на графіт. Графіт можна перетворити на алмаз при високій температурі і великому тиску.
З найдрібніших частинок графіту складаються сажа, деревне вугілля та кокс. Сажа утворюється при неповному згорянні палива. Деревне вугілля отримують при нагріванні деревини без доступу повітря, а кокс — переробкою кам'яного вугілля.
Деревне вугілля має пористу будову і має здатність поглинати гази і розчинені речовини. Така властивість називається адсорбцією.

Хімічні властивості
Алотропні модифікації Карбону в хімічних реакціях можуть проявляти і окисні, і відновні властивості. Окисні властивості Карбону виражені слабше, ніж у інших неметалів другого періоду (Нітрогену, Оксигену і Флуору).
- Взаємодія з металами.
Вуглець реагує з металами при високій температурі з утворенням карбідів:
.
У цій реакції вуглець виступає як окисник.
- Взаємодія з воднем.
Реакція відбувається при сильному нагріванні. Утворюється метан. Вуглець — окисник.
.
- Взаємодія з киснем.
Вуглець горить у кисні з утворенням вуглекислого газу і проявляє в цій реакції відновні властивості:
.
- Взаємодія з оксидами металів.
Вуглець здатний відновлювати метали з їх оксидів:
.
Застосування простих речовин
Алмаз застосовується:
- для обробки твердих поверхонь;
- для різання скла;
- для виготовлення бурів і свердел;
- для виготовлення ювелірних прикрас.
Графіт використовується:
- при виготовленні олівців;
- як тверде мастило в підшипниках;
- для виготовлення електродів;
- як сповільнювач нейтронів в ядерних реакторах;
- для отримання штучних алмазів.
Сажа:
- входить до складу друкарської фарби, крему для взуття;
- використовується як наповнювач для виробництва гуми.
Вугілля використовується:
- в протигазах, промислових і побутових фільтрах;
- для очищення цукрового сиропу, спирту, тощо;
- в медицині.
Кокс застосовується в металургійній промисловості.