Силіцій(\(IV\)) оксид, або кремнезем — тверда тугоплавка речовина, нерозчинна у воді. На відміну від оксидів інших неметалів він має немолекулярну будову. Кожен атом Силіцію у його ґратці сполучається ковалентними зв'язками з чотирма атомами Оксигену, а кожен атом Оксигену — з двома атомами Силіцію. Утворюється кристалічна ґратка атомного типу. Молекул не існує, а формула показує найпростіше співвідношення числа атомів Силіцію і Оксигену в цій речовині.
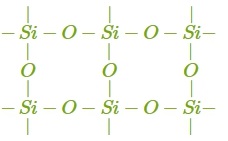
У природі силіцій(\(IV\)) оксид зустрічається у вигляді піску, кремнезему, кварцу, гірського кришталю, аметисту та ін.

У результаті хімічних реакцій отримують пористий силіцій(\(IV\)) оксид — силікагель.

Силікагель
За хімічними властивостями силіцій(\(IV\)) оксид — кислотний оксид. Він вступає в реакції з основними і амфотерними оксидами, з лугами. При цьому утворюються солі силікатної (кремнієвої) кислоти — силікати:
;
.
На відміну від інших кислотних оксидів він не реагує з водою.
При нагріванні взаємодіє з карбонатами і витісняє з них вуглекислий газ:
.
Ще одна особливість силіцій(\(IV\)) оксиду — взаємодія з гідроген флуоридною (плавіковою) кислотою :
.
За допомогою гідроген флуоридної кислоти можна наносити малюнки або написи на скло, оскільки його основу складає силіцій(\(IV\)) оксид.
Використання
Силіцій(\(IV\)) оксид використовується:
- для виробництва віконного скла та скляного посуду;

Віконне скло
- для виготовлення кварцових ламп і термостійкого лабораторного посуду;

Лабораторний посуд з кварцового скла
- для приготування бетону — суміші піску та цементу;

Бетонні плити
- силікагель застосовується як адсорбент для поглинання вологи.