Сульфатна кислота
Сульфатна (сірчана) кислота — найважливіша сполука Сульфуру. Чиста сульфатна кислота являє собою безбарвну в'язку маслянисту рідину, яка майже у два рази важча за воду.
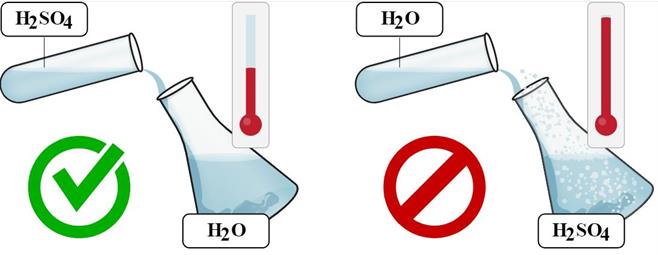
Сульфатна кислота необмежено змішується з водою. Розчинення сульфатної кислоти супроводжується сильним розігріванням розчину, і може відбуватися його розбризкування. Тому сульфатну кислоту розчиняють обережно: тонкою цівкою кислоту вливають у воду при постійному перемішуванні.
Сульфатна кислота дуже гігроскопічною і використовується для осушення різних речовин.
Хімічні властивості сульфатної кислоти залежать від її концентрації.
Сульфатна кислота будь-якої концентрації реагує:
- з основними і амфотерними оксидами і гідроксидами з утворенням солі і води:
,
;
- з солями, якщо утворюється газ чи нерозчинна речовина:
,
.
Розбавлена кислота реагує лише з металами, які розташовані у ряду активності до водню. В реакції утворюються сульфати і виділяється водень. Окисні властивості у цьому випадку виявляють атоми Гідрогену:
.
Концентрована кислота реагує:
- з усіма металами, крім золота і платини, за рахунок сильних окисних властивостей атому Сульфуру:
.
У реакціях з активними металами продуктами реакції можуть бути сульфур(\(IV\)) оксид, гідроген сульфід, або сірка.
Зверни увагу!
При низькій температурі сульфатна кислота пасивує залізо і алюміній і з ними не реагує.
- З твердими солями інших кислот:
.
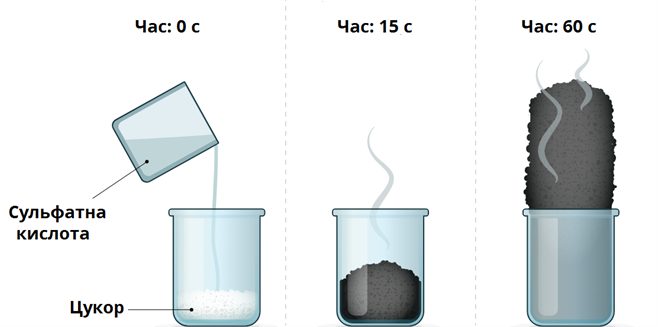
- З багатьма органічними речовинами (відбувається обвуглювання цукру, паперу, деревини, тощо, оскільки віднімається вода):
Солі сульфатної кислоти
Сульфатна кислота утворює два ряди солей. Середні солі називаються сульфатами (), а кислі — гідрогенсульфатами ().
Якісною реакцією на сульфатну кислоту і її солі є реакція з розчинними солями барію — випадає білий осад барій сульфату:
Застосування
Сульфатна кислота — одна з найважливіших хімічних речовин. Вона використовується:
- для отримання інших кислот;
- для виробництва мінеральних добрив;
- для очищення нафтопродуктів;
- у свинцевих акумуляторах;
- у виробництві миючих засобів, барвників, ліків.
Солі сульфатної кислоти також знаходять застосування. Мідний купорос використовується для боротьби із захворюваннями рослин, гіпс використовується в будівництві, барій сульфат — у медицині.
