Положення неметалічних елементів у Періодичній системі, особливості будови і властивостей їх атомів
У Періодичній системі неметалічні хімічні елементи займають правий верхній кут і містяться тільки у головних (\(А\)) групах.

В електронній оболонці атомів неметалів на зовнішньому енергетичному рівні, як правило, міститься від \(4\) до \(8\) електронів. Виняток становлять лише Гідроген \(H\), у якого в електронній оболонці атому взагалі тільки один електрон, Гелій \(He\) з двома електронами і Бор \(B\), у якого на зовнішньому енергетичному рівні є три електрони.
Радіуси атомів неметалів є меншими, ніж у металів того ж періоду, тому в силу близькості позитивно зарядженого ядра атому, неметали добре утримують свої валентні електрони (електрони зовнішнього енергетичного рівня).
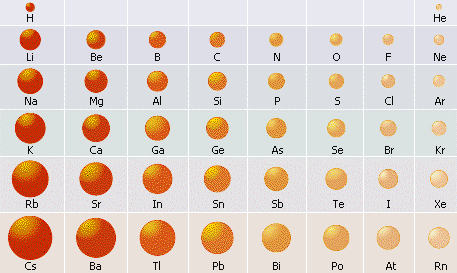
Характер зміни радіусів атомів хімічних елементів у періодах і в групах. Радіуси атомів неметалічних елементів є значно меншими, ніж радіуси атомів металічних елементів, що містяться у тому самому періоді.
Головна відмінна властивість неметалів — це їх висока електронегативність, тобто здатність у хімічних сполуках притягувати електрони.
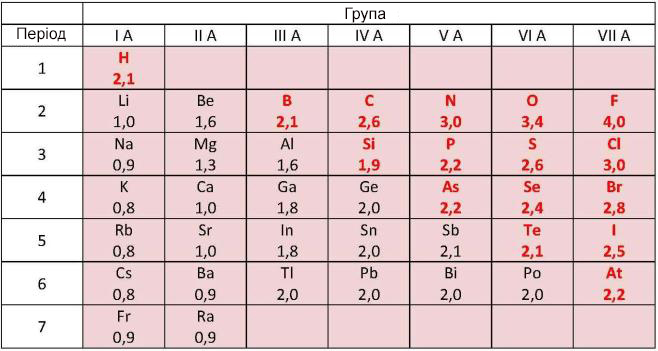
Величини відносних електронегативностей (ВЕН) деяких хімічних елементів (по Л. Полінгу). ВЕН неметалічних хімічних елементів (виділені червоним кольором) перевершує відповідну величину металічних хімічних елементів
Атоми неметалів здатні як приймати, так і віддавати електрони, отже хімічні речовини, що містять такі атоми, у ході перетворень можуть бути як окисниками, так і відновниками.