Загальна кількість електронів в атомі дорівнює порядковому номеру хімічного елемента у періодичній таблиці.
Кожен електрон міститься на своїй орбіталі. Чим більше енергія електрона, тим більше за розміром його орбиталь, і тим далі він знаходиться від ядра.
Електрони з близькими значеннями енергії утворюють енергетичний рівень (електронний шар).
Енергетичний рівень (електронний шар) — сукупність електронів з близькими значеннями енергії.
Енергетичні рівні нумерують, починаючи з найближчого до ядра.
Встановлено, що максимальне число електронів на енергетичному рівні дорівнює \(2n²\), де \(n\) — його номер. Отже, на першому рівні може перебувати не більше \(2\) електронів, на другому — не більше \(8\), на третьому — не більше \(18\), тощо.
В атомі Гідрогену — один електрон, і він міститься на першому енергетичному рівні:
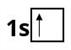
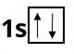
В атомі Гелію — два електрони. Перший енергетичний рівень у Гелію завершений, оскільки він не може містити більше двох електронів:
В атомі Літію — три електрони. Два з них містяться на першому енергетичному рівні. Третій електрон має більшу енергію і рухається далі від ядра. В атомі Літію з'являється другий енергетичний рівень:
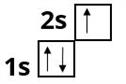
У наступних елементів другого періоду електрони додаються на другий рівень.
Берилій :
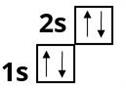
Бор :
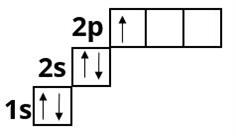
Якщо підрівень має декілька орбіталей, на яких міститься більше одного електрона, то вони займають вільні орбіталі, згідно правилом Хунда:
На одному енергетичному підрівні електрони розподіляються таким чином, щоб число неспарених електронів було максимальним.
Карбон :
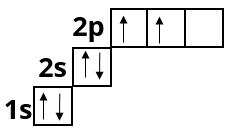
Нітроген :
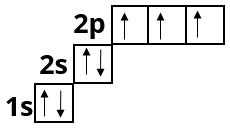
Оксиген :
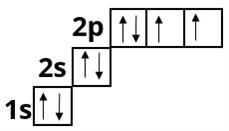
Флуор :
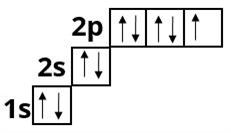
Неон :
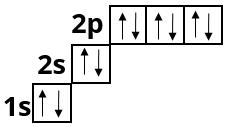
У Неону другий електронний шар завершений, оскільки містить \(8\) електронів — максимально можливе число.
Заповнення третього енергетичного рівня починається у атома Натрію і завершується у атома Аргону:
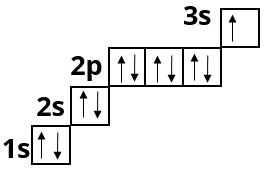
Магній :
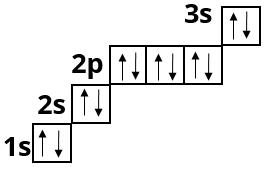
Алюміній :
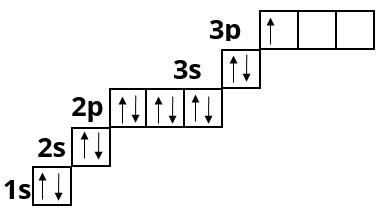
Силіцій :
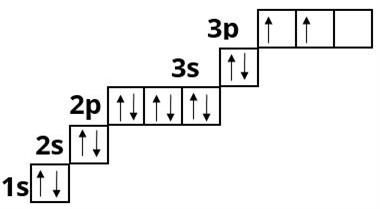
Фосфор :
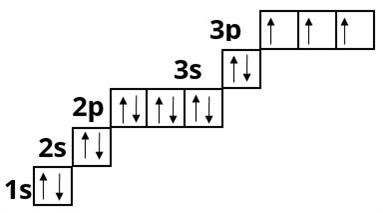
Сульфур :
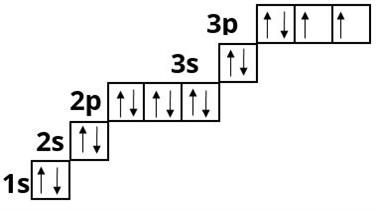
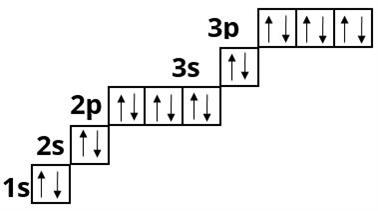
Хлор :
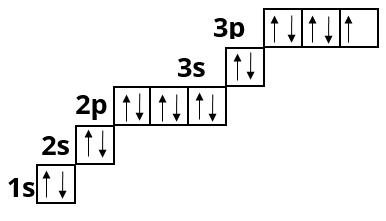
Аргон :
Максимальна кількість електронів на третьому енергетичному рівні дорівнює \(18\), але у елементів третього періоду його заповнення не відбувається, тому що зовнішній електронний шар не може містити більше \(8\) електронів.
Зверни увагу!
На зовнішньому електронному шарі не може бути більше \(8\) електронів.
У елементів четвертого періоду починається заповнення четвертого енергетичного рівня:
— ;
— .
Повністю четвертий електронний шар заповнюється, як і в малих періодах, у інертного газу Криптону.
Електрони в атомах розміщуються таким чином, щоб їхня енергія була мінімальною. Розміщення енергетичних рівнів за зростанням енергії:
, тощо.