Залежно від типу орбіталі, яка останньою заповнюється, розрізняють s - елементи, p - елементи, d - елементи та f - елементи.
Якщо в атомі елемента останнім заповнюються s - підрівні, то це є s - елементи. Вони містяться у головних підгрупах І та ІІ груп: Літій, Берилій, Натрій, Берилій, Натрій, Магній, Калій, Кальцій, тощо. До s - елементів належить і Гелій.
Приклад:
електронні формули s - елемента Літію
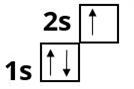
та Магнію :
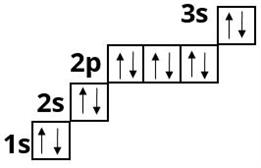
У p - елементів відбувається заповнення p - підрівня. Це елементи головних підгруп III — VIII груп.
Приклад:
Бор :
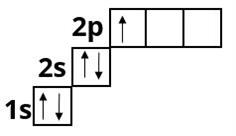
Сульфур :
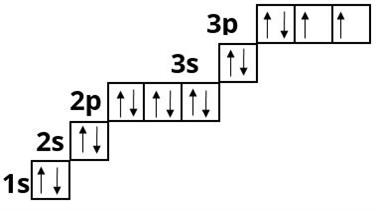
d - елементи — це елементи побічних підгруп — у них відбувається заповнення d - підрівня: Скандій , Титан, Ванадій, Хром, Манган, тощо.
До f - елементів належать лантаноїди та актиноїди: Церій, Празеодим, Неодим, Прометій, Самарій, тощо.