Закон збереження маси речовин у хімічних реакціях був сформульований на основі робіт по прокалюванню металів.
У ст. англійський вчений Р. Бойль проводив досліди по прокалюванню свинцю. Після закінчення дослідів він зважував отримані речовини та порівнював їх масу з масою вихідного металу. Маса окалини завжди була більша за масу свинцю.
Російський учений М. В. Ломоносов повторив досліди Р. Бойля. Але метали він прожарював у запаяних скляних посудинах — ретортах. Зважування посудин до і після реакції показало, що їх маса залишається незмінною.
У \(1748\) р. М. В. Ломоносов дав своє формулювання закону збереження маси речовини такими словами: « … усі зміни, що трапляються в натурі, такого суть стану, що скільки чого в одного тіла відніметься, стільки додається до іншого, так, якщо де трохи зменшиться матерії, то збільшиться в іншому місці…».
У \(1789\) г. французький хімік А. Лавуазьє пояснив причину різних результатів зважування речовин у відкритих і закритих посудинах. Він довів, що утворення окалини відбувається за рахунок приєднання до металу кисню, що міститься у повітрі.
На основі робіт М. В. Ломоносова і А. Лавуазьє було сформульовано закон збереження маси.
Маса речовин, що вступили в хімічну реакцію, дорівнює масі речовин, що утворилися.
Під час хімічних реакцій атоми не зникають і не з'являються. Продукти реакції утворюються з атомів, що містяться у вихідних речовинах. Тому маса і залишається незмінною.
Приклад:
Реакція горіння природнього газу (метану):
метан \(+\) кисень \(=\) вуглекислий газ \(+\) вода.
Вихідні речовини — метан і кисень :
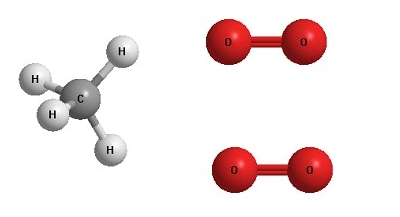
Продукти реакції — вуглекислий газ і вода :
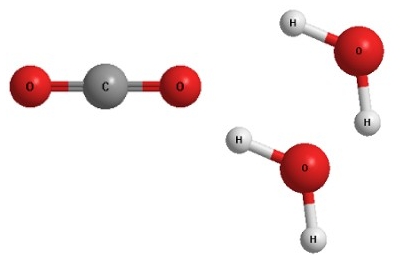
У молекулах вихідних речовин і в молекулах продуктів реакції містяться атоми Карбону, Гідрогену і Оксигену. Їх кількість не змінюється, тому і маса речовин залишається незмінною.
маса метану \(+\) маса кисню \(=\) маса вуглекислого газу \(+\) маса води,
.
