Ще понад \(2000\) років тому люди замислювалися над тим, із чого складаються речовини. Розмірковуючи над цим питанням, давньогрецький філософ Демокрит припустив, що всі речовини мають складатися з частинок, із дуже маленькими масами. Він назвав їх атомами, що означає «неподільні».
Знання про будову і властивості атомів необхідні, щоб розумітися на будові та хімічних перетвореннях речовин.
Існування атомів було доведено порівняно недавно, лише у \(XIX\) столітті. Також було встановлено, що атом не є неподільною частинкою. Термін «атом» запропонував Дж. Дальтон на початку \(XIX\) століття. Він назвав атомами найдрібніші частинки, які не змінюються в хімічних реакціях.
Атом складається з протонів, нейтронів та електронів. Протони й нейтрони утворюють ядро атома, в якому зосереджена майже вся маса атома. Протони заряджені позитивно, нейтрони заряду не мають. Вважають, що заряд протона дорівнює \(+1\). Кількість протонів у ядрі дорівнює чисельному значенню заряду ядра атома. Наприклад, якщо в атомі Оксигену \(8\) протонів, то заряд його ядра \(+8\).
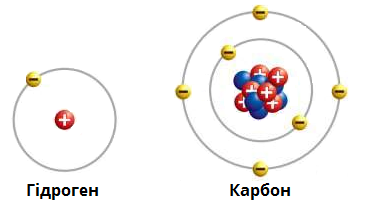
Моделі атомів Гідрогену і Карбону
Електронною оболонкою називають простір навколо ядра атома, в якому перебувають електрони. Ці частинки заряджені негативно і безперервно рухаються. Заряд електронів дуже маленький. Частинок із меншим зарядом у природі не існує, тому заряд електрона приймають за одиницю заряду (\(—1\)), а електрони позначають .
У кожному атомі кількість електронів і протонів однакова. Якщо заряд ядра атома дорівнює \(+1\), то такий атом містить один електрон (у сумі \(+1\)— \(1\) = \(0\), а якщо заряд ядра дорівнює \(+2\), то в атомі є два електрони тощо.
Атом — найдрібніша електронейтральна хімічно неподільна частинка речовини, що складається з позитивно зарядженого ядра й негативно заряджених електронів, що рухаються навколо нього і утворюють електронну оболонку.
На початку \(XX\) століття данський фізик Ернест Резерфорд запропонував одну з перших моделей будови атомів. Він порівнював атом із Сонячною системою. Але це порівняння дуже приблизне, оскільки атом має складнішу будову.
Розміри атомів настільки малі, що побачити їх неможливо навіть у найпотужніший мікроскоп — близько \(0,0000000001\) м, а ядро атома ще менше: його діаметр становить близько \(0,000000000000001\) м, тобто в сто тисяч разів менший, ніж діаметр атома. Деякі дослідники проводять порівняння: якби ядро атома було розміром з яблуко, то атом був би розміром із планету Земля".
Атоми мають вигляд сфери, тому що електрони обертаються навколо ядра з неймовірною швидкістю. І спостерігачеві здається, що електрони перебувають одночасно в усіх точках їхнього руху. Подібне відбувається, коли ми спостерігаємо за увімкненим вентилятором. Ми бачимо перед собою суцільний диск, а не окремі лопаті пропелера.
Атоми можна уявити як мініатюрні цеглинки, з яких побудований весь навколишній світ. Вони є основою всіх речовин, що існують у природі. Речовини можуть складатися як з окремих атомів, так і з йонів, що утворюються з атомів, а також з атомів, об'єднаних у молекули.
Атоми, молекули та йони — структурні частинки речовин. Усе, що ми бачимо навколо себе, від краплини води до зорі на небі, складається з атомів, що сполучені у різний спосіб.
Атоми можуть приєнувати або втрачати електрони, перетворюючись на йони.
Йони — це одноатомні або багатоатомні частинки, що мають електричний заряд.
Існують речовини, що складаються не з атомів, а з йонів.
Джерела:
Хімія: підруч. для 7-го кл. закл. заг. серед. освіти / Григорович О., Недоруб О. — Київ: Ранок, 2024. с. 51 - 54.
Хімія: підруч. для 7-го кл. закл. заг. серед. освіти / Ярошенко О.Г., Кошевнюк Т.В. — Київ: УОВЦ «Оріон», 2024. с. 52 - 56.
