Кислоти мають цілу низку загальних хімічних властивостей.
1. Дія кислот на індикатори
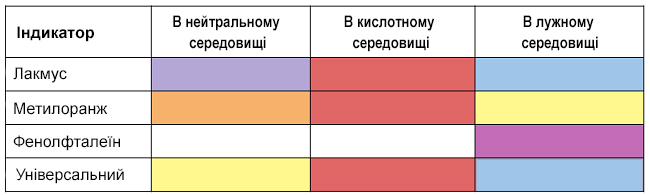
Водні розчини кислот змінюють забарвлення індикаторів.
У кислому середовищі фіолетовий лакмус, метилоранж і універсальний індикатор стають червоними.
Забарвлення деяких індикаторів в різних середовищах
2. Взаємодія кислот з металами
Кислоти взаємодіють з металами, що стоять в ряду активності металів лівіше водню. В результаті реакції утворюється сіль і виділяється водень.
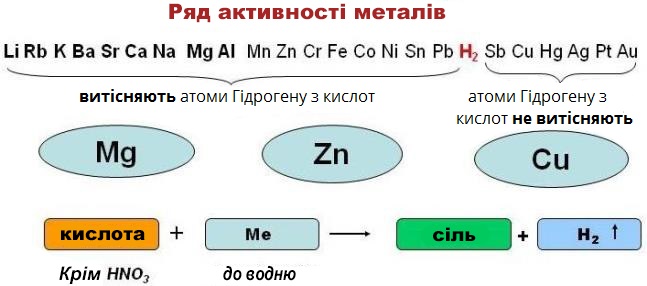
Можна сказати, що метали, розташовані в ряду активності лівіше, витісняють атоми Гідрогену з кислот.
Наприклад, при взаємодії магнію з хлоридною кислотою утворюється магній хлорид і виділяється водень:
.
Зверни увагу!
Нітратна кислота і концентрована сульфатна кислота з металами взаємодіє інакше (сіль утворюється, але водень при цьому не виділяється).
3. Взаємодія кислот з основними і амфотерними оксидами
Кислоти реагують з основними і амфотерними оксидами. У результаті реакції утворюється сіль і вода.
Наприклад, при взаємодії основного калій оксиду з нітратною кислотою утворюється сіль калій нітрат, а при взаємодії амфотерного алюміній оксиду з хлоридною кислотою утворюється сіль алюміній хлорид:
4. Взаємодія кислот з основами і з амфотерними гідроксидами
Кислоти реагують з основами і з амфотерними гідроксидами, утворюючи сіль і воду.
Так само, як і в попередньому прикладі, при взаємодії калій гідроксиду і алюміній гідроксиду з кислотами утворюються відповідні солі:
Реакції між кислотами і основами називають реакціями нейтралізації.
5. Взаємодія кислот з солями
Реакції між кислотами і солями можливі, якщо в результаті утворюється практично нерозчинна у воді речовина (випадає осад) або утворюється летка речовина (газ).
- Кислоти реагують з розчинами солей, якщо в результаті реакції один з продуктів випадає в осад.
Наприклад, при взаємодії розчину сульфатної кислоти з розчином барій хлориду в осад випадає барій сульфат, а при взаємодії розчину натрій силікату з розчином нітратної кислоти в осад випадає силікатна кислота:
- Продукт реакції при звичайних умовах, або при нагріванні випаровується.
Наприклад, при дії концентрованої сульфатної кислоти на кристалічний натрій хлорид, утворюється газоподібний гідроген хлорид, а при дії хлоридної кислоти на ферум(\(II\)) сульфід виділяється газ гідроген сульфід:
Примітка. Скорочення (т.р.) Означає «тверда речовина», а (конц.) — «концентрований розчин».
-
Якщо кислота, яка вступає в реакцію, є сильнішою, за ту кислоту, що утворюється.
Наприклад, хлоридна кислота може витіснити карбонатну з її солі:
Для того, щоб винести судження про можливість протікання реакції, можна скористатися витискувальним рядом кислот:
У цьому ряду кислота, що знаходиться лівіше, може витіснити з солі кислоту, що знаходиться правіше.
При розкладанні кислот утворюється кислотний оксид і вода. Карбонатна кислота розкладається при звичайних умовах, а сульфітна і силікатна кислоти — при невеликому нагріванні:
Таким чином, можна зробити висновок, що кислоти:
-
змінюють колір індикаторів;
-
реагують з металами;
-
реагують з основними і амфотерними оксидами;
-
реагують з основами і амфотерними гідроксидами;
-
реагують з солями;
-
деякі кислоти легко розкладаються.