Оксидами називають складні речовини, які складаються з двох хімічних елементів, одним з яких є Оксиген.
В оксидах хімічний елемент Оксиген має валентність \(ІІ\), ступінь окиснення \(-2\).
Оксиди — досить поширений в природі клас сполук. Вони знаходяться в повітрі, поширені в гідросфері і літосфері.
Приклади оксидів:
— гідроген оксид або вода.
На Землі вода зустрічається у всіх трьох агрегатних станах — газоподібному (водяна пара), рідкому і твердому (лід, сніг). На долю води також припадає значна частина маси живих організмів.
 |
 |
 |
Агрегатні стани води
— карбон(\(IV\)) оксид, двоокис карбону або вуглекислий газ.
Як ви вже знаєте, вуглекислий газ потрібен зеленим рослинам для фотосинтезу. Карбон(\(IV\)) оксид, що знаходиться у твердому агрегатному стані, називають сухим льодом.

Твердий карбон(\(IV\))оксид — сухий льод
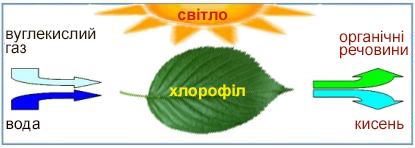
Процес фотосинтезу
— карбон(\(II\)) оксид, монооксид карбону, чадний газ.
Домішка цієї дуже отруйної речовини може міститися в повітрі. Основним джерелом забруднення повітря чадним газом є транспорт. Чадний газ утворюється в результаті неповного згоряння палива. Цей оксид може утворюватися і під час пожеж.
 |
 |
Утворення вуглекислого газу
— ферум(\(III\)) оксид.
У природі цей оксид зустрічається у вигляді мінералу гематиту. Він є основою руди, яку називають червоним залізняком.
 |
 |
Червоний залізняк
— силіцій оксид.
У природі зустрічається у вигляді кварцевого піску, кварцу, гірського кришталю.
 |
 |
 |
Класифікація оксидів
Оксиди прийнято групувати в залежності від їх здатності реагувати з кислотами і основами. Розрізняють три найважливіші групи оксидів: основні, кислотні та амфотерні. Їх відносять до солетворних оксидів. Існують також оксиди, які називають несолетворними.
- Основні оксиди
Основними називають оксиди, які реагують з кислотами, утворюючи сіль і воду.
Приклади основних оксидів: натрій оксид , купрум(\(II\)) оксид .
- Кислотні оксиди
Кислотними називають оксиди, які реагують з основами, утворюючи сіль і воду.
Кислотні оксиди утворюють елементи — неметали. Наприклад, сульфур(\(VI\)) оксид , нітроген(\(IV\)) оксид .
Кислотні оксиди можуть бути утворені і металічними хімічними елементами, в яких вони проявляють ступінь окиснення від \(+5\) до \(+8\). Наприклад, хром(\(VI\)) оксид і манган(\(VII\)) оксид .
- Амфотерні оксиди
Амфотерними називають оксиди, які реагують як з кислотами, так і з основами, утворюючи солі.
Амфотерні властивості проявляє цинк оксид , алюміній оксид , берилій оксид .
Якщо металічний елемент має змінну валентність (проявляє кілька ступенів окиснення), то з усіх утворених ним оксидів, амфотерними властивостями володіють ті, в яких цей елемент має проміжну валентність (проміжну ступінь окиснення).
Наприклад, хром може бути двохвалентним, трьохвалентним і шестивалентним.
Амфотерними властивостями володіє саме хрому(\(III\)) оксид .
- Несолетворні оксиди
Несолетворними називають оксиди, які при звичайних умовах не взаємодіють ні з кислотами, ні з основами.
Таких сполук всього три: карбон(\(II\)) оксид, або чадний газ , нітроген(\(I\)) оксид та нітроген(\(II\)) оксид .
Номенклатура оксидів
Для назви сполуки оксиду спочатку вказують елемент, що входить до складу оксиду у називному відмінку, потім додают слово «оксид»:
Наприклад: — купрум(\(I\)) оксид, — купрум(\(II\)) оксид, — ферум(\(II\)) оксид, — ферум(\(III\)) оксид, — хлор(\(VII\)) оксид.
Інколи використовують й інші найменування оксидів.
За кількістю атомів Оксигену: якщо оксид містить лише один атом Оксигену, то його називають монооксидом або моноокисом, якщо два — диоксидом або двоокисом, якщо три — то триоксидом або триокисом, тощо.
Наприклад: карбон монооксид , карбон двоокис , сульфур триоксид .
Також поширені історично сформовані (тривіальні) назви оксидів, наприклад, чадний газ , сірчаний ангідрид , тощо.