Нукліди
Вид атомів з певним числом протонів і нейтронів у ядрі називається нуклідом.
Нуклід позначається наступним чином: внизу зліва записується число протонів \(Z\) (порядковий номер), угорі ліворуч вказується масове число \(A\) (сума чисел протонів і нейтронів) — , наприклад: ; .
Для позначення нуклідів використовують і інші способи запису:
Карбон — \(12\), — \(12\), ;
Селен — \(79\), — \(79\), .
Ізотопи
Атоми одного і того ж хімічного елемента можуть мати різні маси. Існують атоми Гідрогену з масами \(1\), \(2\) і \(3\), атоми Хлору з масами \(35\) і \(37\), тощо.
Різновиди атомів одного хімічного елемента, які мають різні атомні маси, називають ізотопами.
З врахуванням знань про будову ядра, це визначення можна сформулювати наступним чином:
Ізотопи — різновиди атомів з однаковим числом протонів у ядрі (зарядом ядра), але різним числом нейтронів.
Отже, ізотопи відрізняються тільки числом нейтронів.
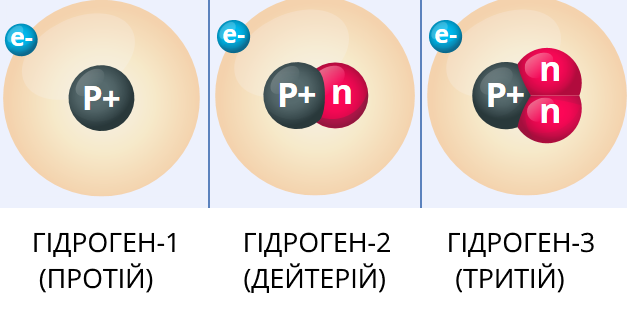
Протони визначають властивості атома, тобто надають йому індивідуальність. А нейтрони не впливають на властивості атома, а відображаються на його масі. Тому всі ізотопи одного і того ж елемента хімічно не відрізняються.
Хімічний елемент — це вид атомів з певним зарядом ядра.
Відносна атомна маса елемента
Більшість хімічних елементів існують у вигляді суміші ізотопів. Наведена у періодичній таблиці відносна атомна маса елемента — це середня величина атомних мас всіх його ізотопів.
Приклад:
визначимо відносну атомну масу Хлору. \(25\) % його атомів — це атоми з масою \(37\), а \(75\) % — з масою \(35\). Знайдемо середнє значення:
\(=\) 35,5.
