Графічним відображенням Періодичного закону є Періодична система хімічних елементів. Відомо понад \(700\) форм періодичної таблиці. Офіційним за рішенням Міжнародного союзу хіміків є її напівдовгий і довгий варіант.

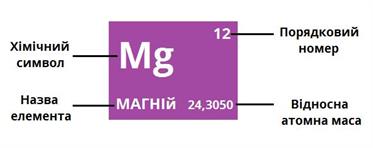
Кожному хімічному елементу в таблиці відведена одна клітинка, в якій вказані символ і назва елемента, порядковий номер і відносна атомна маса.
Послідовність розташування елементів не завжди збігається зі зростанням атомної маси. Є кілька винятків із правила. Так, відносна атомна маса Аргону менше атомної маси Калію, а у Телуру — менше, ніж Йоду.
Кожен елемент має свій порядковий (атомний) номер, розташовується в певному періоді і певній групі.
Період — горизонтальний ряд хімічних елементів, який починається лужним металічним елементом (чи Гідрогеном) закінчується інертним (благородним) елементом.
У таблиці сім періодів. У кожному міститься певна кількість елементів:
\(1\)-й період — \(2\) елементи,
\(2\)-й період — \(8\) елементів,
\(3\)-й період — \(8\) елементів,
\(4\)-й період — \(18\) елементів,
\(5\)-й період — \(18\) елементів,
\(6\)-й період — \(32\) елементи (\(18 + 14\)),
\(7\)-й період — \(32\) елементи(\(18 + 14\)).
Три перших періоди називають малими періодами, усі інші — великими. І в малих, і у великих періодах відбувається поступове послаблення металічних властивостей і посилення неметалічних, лише у великих періодах це відбувається більш плавно.
Елементи з порядковими номерами \(58\) – \(71\) (лантаноїди) і \(90\) – \(103\) (актиноїди) винесені з таблиці та розташовані під нею. Це елементи групи. Лантаноїди відносяться до шостого періоду, а актиноїди — до сьомого.
Восьмий період з'явиться в Періодичної таблиці, коли будуть відкриті нові елементи.
Група — вертикальний стовпчик хімічних елементів, які мають подібні властивості.
У Періодичній таблиці \(18\) груп, пронумерованих арабськими цифрами. Часто використовують нумерацію римськими цифрами з додаванням букв \(A\) чи \(B\). У такому випадку груп \(8\).
Групи \(A\) починаються елементами малих періодів, включають також і елементи великих періодів; містять і металічні і неметалічні елементи. У короткому варіанті Періодичної таблиці це головні підгрупи.
Групи \(B\) починаються елементами малих періодів, включають також і елементи великих періодів; містять і металічні, і неметалічні елементи. У короткому варіанті Періодичної таблиці це побічні підгрупи.
Число елементів у групах:
, — по \(7\) елементів;
— — по \(6\) елементів;
— \(32\) елементи (\(4 + 14\) лантаноїдів \(+ 14\) актиноїдів);
— \(12\) елементів;
, , — — по \(4\) елементи.
Кількісний склад груп буде змінюватися в міру додавання в таблицю нових елементів.
Римський номер групи, як правило, показує вищу валентність в оксидах. Але для деяких елементів це правило не виконується. Так, Флуор не може мати валентність сім, а Оксиген — шість. Не проявляють валентність, що дорівнює номеру групи Гелій, Неон і Аргон — ці елементи не утворюють сполук з Оксигеном. Купрум буває двохвалентним, а Аурум — трьохвалентним, хоча це елементи першої групи.
Деякі групи \(A\) отримали особливі назви:
— лужні металічні елементи (, , , , , );
(крім Берилію і Магнію) — лужноземельні металічні елементи (, , , );
— галогени (, , , , );
— благородні, або інертні елементи (, , , , , , ).
