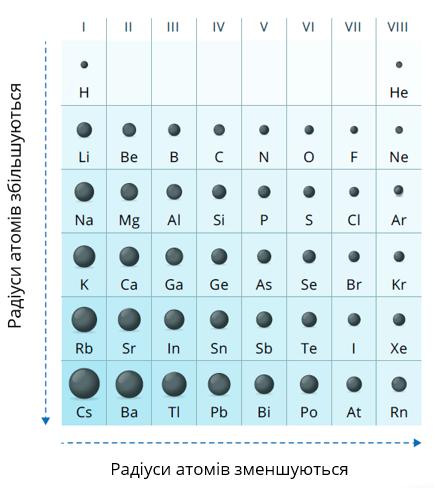
Однією з найважливіших характеристик атома є його радіус.
Зміна радіусів атомів в групах
Радіус атома визначається числом енергетичних рівнів в ньому. Чим більше рівнів заповнено електронами, тим більше радіус атома.
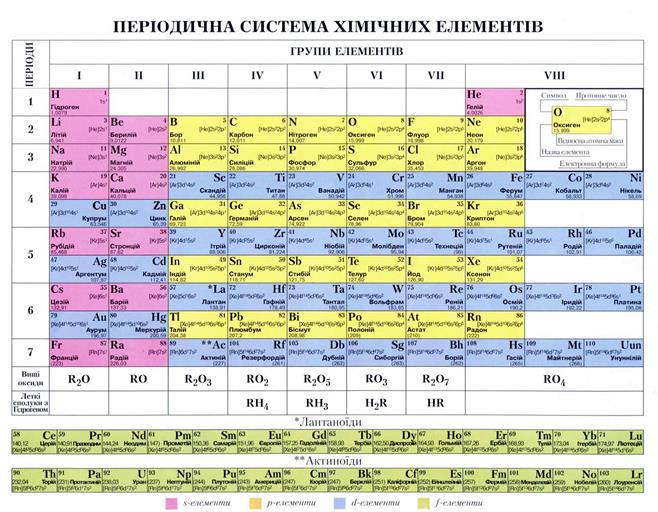
Згадаємо будову електронних оболонок елементів та груп:
; ; ;
; ; .
Зі збільшенням порядкового номера в групі радіуси атомів збільшуються. У кожній групі найбільші радіуси у елементів сьомого періоду.
Зміна радіусів атомів в періодах
В елементах одного періоду число енергетичних рівнів в атомах є однаковим. Збільшуються заряд ядра і число зовнішніх електронів.
; ; .
Зовнішні електрони все сильніше притягуються до позитивно зарядженого ядра, атоми стискаються, і за рахунок цього їх радіуси зменшуються. Найбільші радіуси в кожному періоді — в елементах групи (у лужних металів).