Періодичний закон сформульовано Д. І. Менделєєвим у \(1869\) році. На той час було відомо \(63\) хімічні елементи. Як основні властивості елементів Менделєєв обрав відносну атомну масу. Враховував також склад, фізичні та хімічні властивості утворених елементом простих і складних речовин.
Розташувавши всі відомі хімічні елементи в порядку зростання атомних мас, Менделєєв виявив, що властивості повторюються через певне число елементів.
Повторимо дії Менделєєва з урахуванням того факту, що благородні гази на той час ще не були відомі. Розташуємо елементи за зростанням атомної маси (другий рядок таблиці), вкажемо металічні та неметалічні властивості, формули і властивості вищих оксидів і гідроксидів, а також формули газоподібних сполук з Гідрогеном.
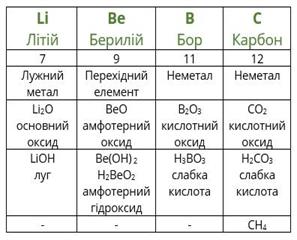
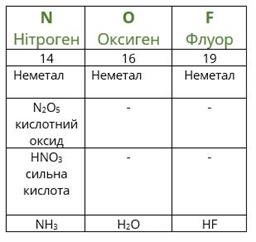
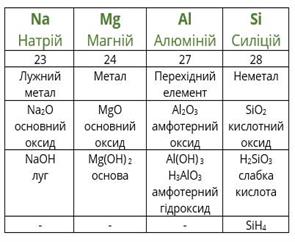
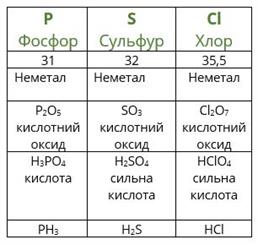
Якщо уважно проаналізувати отримані послідовності, то можна побачити повторюваність металічних і неметалічних властивостей, складу і властивостей сполук. Через сім елементів від лужного металічного елемента Літію в ряду розташовується лужний металічний елемент Натрій, а через сім елементів від галогену Флуору — галоген Хлор. Через сім елементів з'являються однакові формули оксидів і сполук з Гідрогеном, оскільки повторюються значення валентностей в сполуках з Оксигеном і Гідрогеном. Можемо скласти їх загальні формули.
Формули вищих оксидів: .
Леткі сполуки з Гідрогеном (для неметалів): .
Таким чином Менделєєв встановив періодичність зміни властивостей зі зростанням атомної маси. У статті «Періодична закономірність хімічних елементів» Д. І. Менделєєв дав наступне формулювання періодичного закону:
У перекладі на сучасну наукову мову це звучить наступним чином:
«Властивості елементів, а тому і властивості утворених ними простих і складних тіл, знаходяться у періодичній залежності від атомної маси».
«Властивості простих речовин, а також склад і властивості сполук елементів знаходяться в періодичній залежності від відносних атомних мас».
Всі елементи Менделєєв поділив на періоди.
Період — ряд елементів, розташованих в порядку зростання відносної атомної маси, що починається лужним металічним елементом і закінчується елементом галогеном і інертним газом.
У періоді:
• поступово послаблюються металічні властивості простих речовин і посилюються неметалічні;
• вища валентність елементів за Оксигеном зростає від (у лужних металічних елементів) до (у галогенів);
• валентність неметалічних елементів в летких сполуках з Гідрогеном зменшується від до (у галогенів);
• властивості вищих оксидів і гідроксидів поступово змінюються від основних через амфотерні до кислотних.
• вища валентність елементів за Оксигеном зростає від (у лужних металічних елементів) до (у галогенів);
• валентність неметалічних елементів в летких сполуках з Гідрогеном зменшується від до (у галогенів);
• властивості вищих оксидів і гідроксидів поступово змінюються від основних через амфотерні до кислотних.
Періодичний закон набув подальшого розвитку після вивчення фізиками будови атома. Виявилося, що головною характеристикою хімічного елемента є не відносна атомна маса, а заряд ядра атома. Сучасне формулювання періодичного закону дещо змінене:
«Властивості хімічних елементів і їх сполуки перебувають у періодичній залежності від зарядів атомних ядер».