Усі відомі хімічні елементи можна розділити на металічні і неметалічні. При взаємодії металічного елемента з неметалічним атом першого втрачає електрони, а атом другого їх приймає.
Металічні елементи — атоми яких здатні віддавати електрони.
Неметалічні елементи — атоми яких можуть приймати електрони.
Що відбувається, якщо взаємодіють атоми двох неметалічних елементів?
Порівняємо атоми Сульфуру і Оксигену:
+8 +16
Радіус атома Сульфуру є більшим, валентні електрони слабше пов'язані з ядром. При утворенні зв'язку відбудеться зсув електронів від Сульфуру до Оксигену.
Порівняємо атоми Карбону і Оксигену:
+8 +6
Заряд ядра атома Оксигену більше і притягувати до себе електрони він буде сильніше.
Отже, атоми різних неметалічних елементів притягують до себе електрони неоднаково.
Здатність атомів елементів відтягувати до себе спільні електронні пари в хімічних сполуках, називається електронегативністю (ЕН).
Оскільки загальні електронні пари утворюються валентними електронами, то можна сказати, що електронегативність — це здатність атома притягувати до себе валентні електрони від інших атомів.
Зверни увагу!
Чим більша електронегативність, тим сильніше у елемента виражені неметалічні властивості.
Шкала відносної електронегативності Полінга
Абсолютні значення ЕН — незручні для роботи числа. Тому, зазвичай, використовують відносну електронегативність за шкалою Полінга. За одиницю в ній прийнята ЕН Літію.
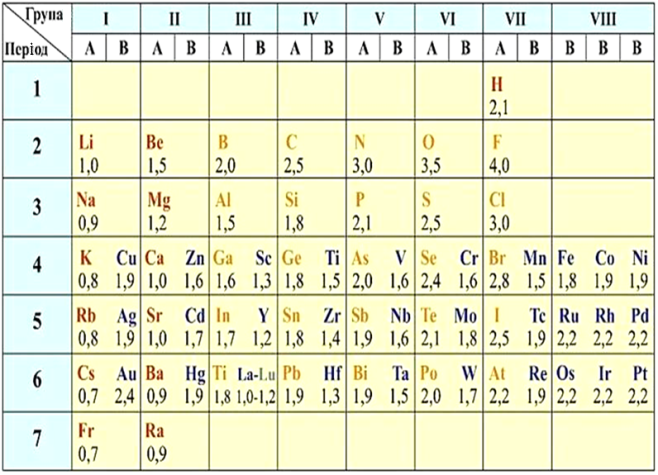
За шкалою Полінга найбільш електронегативним серед елементів, здатних утворювати сполуки, є Флуор, а найменш електронегативним — Францій. ЕН Францію дорівнює \(0,7\), а ЕН Флуору — \(4\). ЕН інших елементів змінюються в межах від \(0,7\) до \(4\).
Як правило, неметалічні елементи мають ЕН більше двох. У металічних значення ЕН менше двох. Деякі елементи () зі значеннями електронегативності, близькими до \(2\), здатні виявляти проміжні властивості.
Елементи з високою і низькою електронегативністю вважаються активними. З високою — активні неметалічні елементи, з низькою — активні металічні елементи. У перших ЕН близька до \(3\ \)— \(4\), у других — до \(1\).
Зміна електронегативності у Періодичній системі
Зі збільшенням порядкового номера елементів ЕН змінюється періодично.
У періоді вона зростає зліва направо при накопиченні електронів на зовнішньому шарі.
У групі вона знижується згори донизу при збільшенні числа електронних шарів і збільшенні атомних радіусів.
Найбільшу ЕН у кожному періоді мають найменші атоми, які мають сім зовнішніх електронів — атоми галогенів (інертні гази сполук не утворюють).
Найменшу ЕН у періоді має найбільший атом з одним зовнішнім електроном — атом лужного елемента.
Зверни увагу!
Значення електронегативності елементів дозволяють визначити
— заряди атомів у сполуці;
— зміщення електронів при утворенні хімічного зв'язку.
Встановимо, як відбувається зміщення електронів при взаємодії атомів Хлору та Сульфуру, Сульфуру та Оксигену.
Приклад:
Хлор і Сульфур розташовані у третьому періоді. Електронегативність за періодом зростає зліва направо. ЕН Хлору більше ЕН Сульфуру, отже, електрони будуть зміщуватися від Сульфуру до Хлору. Заряд атома Сульфуру буде позитивним, а Хлору — негативним.
Перевіримо висновок за шкалою Полінга. Електронегативність Хлору дорівнює 3, а електронегативність Сульфуру — 2,5. Хлор є більш електронегативним елементом.
Приклад:
Оксиген і Сульфур розташовані у шостий А групі. Електронегативність у групі згори донизу зменшується. ЕН Оксигену більше ЕН Сульфуру, отже, електрони будуть зсуватися від Сульфуру до Оксигену. Атом Сульфуру має позитивний заряд, а Оксигену — негативний.
За шкалою Полінга електронегативність Оксигену становить — 3,5, а електронегативність Сульфуру — 2,5. Більш електронегативним є Оксиген.
У хімічних формулах сполук, як правило, на першому місці записується елемент з меншою електронегативністю, після нього — елемент з більшою електронегативністю.
Наприклад, у сполуках , , — Оксиген проявляє негативну електронегативність, інший елемент — позитивну електронегативність.
