Спільні електронні пари, які утворюються в простих речовинах , в однаковій мірі належать обом атомам. Такий ковалентний зв'язок називається неполярним.
Ковалентний неполярний зв'язок сполучає атоми в простих речовинах — неметалах.
Якщо ковалентний зв'язок утворюється між різними атомами, то спільна електронна пара зміщується до того з них, який має вищу електронну негативність (ЕН). Він отримує частковий негативний заряд. Атом, що має меншу ЕН, стає зарядженим позитивно. У цьому випадку утворюється полярний ковалентний зв'язок.
Ковалентний полярний зв'язок утворюється між атомами неметалів у складних речовинах.
Розглянемо утворення ковалентних зв'язків в складних речовинах.
1. Утворення молекули гідроген хлориду.
В атомі Гідрогену на зовнішньому рівні міститься один електрон. У Хлорі на зовнішньому рівні сім електронів, один з яких неспарений.
Утворюється одна спільна електронна пара, яка зміщена до атома Хлору. У результаті з'являються часткові заряди: на атомі Хлору — негативний, а на атомі Гідрогену — позитивний. Зміщення електронної густини прийнято позначати грецькою літерою дельта :
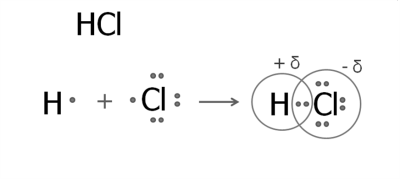
Структурна формула гідроген хлориду
Подібним чином сполучаються атоми в інших молекулах Гідрогену з галогенами:
.
2. Утворення молекули води.
На зовнішньому рівні атома Оксигену — шість електронів, два з яких неспарені.
Атом Оксигену утворює дві спільні електронні пари з двома атомами Гідрогену.
Електронна густина цих спільних пар зміщена до більш електронегативного Оксигену. Атом Оксигену має негативний заряд, а атоми Гідрогену — позитивний.
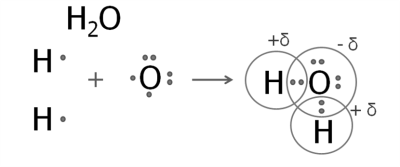
Подібну будову має молекула гідроген сульфіду (сірководню). Структурні формули води і гідроген сульфіду:
3. Утворення молекули амоніаку.
У атома Нітрогену п'ять зовнішніх електронів, три з яких — неспарені.
Атом Нітрогену приєднує до себе три атоми Гідрогену.
Нітроген — більш електронегативний елемент, тому на його атомі буде негативний заряд, а на атомах Гідрогену — позитивні заряди.
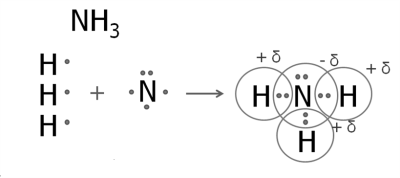
Так само утворюються зв'язки у фосфіну. Структурні формули амоніаку і фосфіну:
Для того щоб визначити знаки часткових зарядів на атомах в речовині, потрібно порівняти ЕН неметалів.
Приклад:
Визначимо часткові заряди атомів у сполуці хлорметану .
Згадаємо положення Карбону і Хлору в ряду ЕН: .
Відповідно до положення елементів в цьому ряду видно, що більш електронегативний елемент в цій парі — Хлор. Його атом відтягує до себе спільні електронні пари від атома Карбону.
Отже, на атомі Хлору буде частково негативний заряд, а на атомі Карбону — частково позитивний: .
Полярний ковалентний зв'язок часто позначають стрілкою: . Стрілка показує напрям зміщення електронної густини.