Будь-яка речовина може існувати в трьох агрегатних станах: твердому, рідкому і газоподібному. Всім відомо, що рідка при кімнатній температурі вода стає твердою при охолодженні до \(0\) °С, а при нагріванні до \(100\) °С перетворюється в пару.
Тверді речовини поділяють на аморфні і кристалічні.
Відмінність аморфних і кристалічних речовин полягає в ступені впорядкованості їх внутрішньої будови.
У кристалічних речовинах всі частинки розташовуються в певному порядку.
В аморфних речовинах цей порядок є відносним.
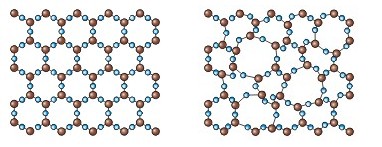
Кристалічними називають речовини, в яких частинки розташовуються в строгому порядку.
Приклади кристалічних речовин: алмаз, цукор, метали, солі, луги, більшість оксидів і простих речовин.

Кристали мідного купоросу

Кристали кварцу
Аморфними називають речовини, у яких немає строгого порядку в розташуванні частинок.
До аморфних речовин відносяться: скло, смола, віск, бурштин, пластилін, жувальна гумка, більшість пластмас.

Пластилін

Бурштин
Кристалічні і аморфні речовини відрізняються властивостями.
При ударі кристалічні речовини розпадаються на дрібні кристалики певної форми.
Аморфні речовини при руйнуванні утворюють уламки невизначеної форми.
Слово «аморфний» перекладається з грецької мови як «безформенний».

Уламки скла
Кристалічні речовини мають певну температуру плавлення, при якій вони відразу стають рідкими. Наприклад, алюміній плавиться при температурі \(660\) °С, а алмаз — при \(3827\) °С.
Якщо нагрівати скло, то воно спочатку розм'якшується і перетворюється на пластичну масу.
Аморфні речовини не мають точної температури плавлення — при нагріванні вони поступово розм'якшуються і переходять у в'язкий стан. Здатність аморфних речовин ставати вязкими при нагріванні дозволяє надавати їм будь-яку форму.
