Поняття атомної маси запровадив Джон Дальтон у \(1803\) році.
Атом — електронейтральна частинка, що складається з позитивно зарядженого ядра і негативно заряджених електронів.
Ядро атома складається з елементарних частинок: протонів і нейтронів.
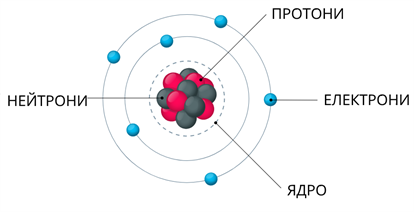
Протони і нейтрони мають однакову масу. Маса електрона складає \(1/1840\) маси протона і нейтрона. Основна маса атома зосереджена у його ядрі.
Реальні маси атомів є дуже малими. Так, абсолютна маса атома Гідрогену становить г, Карбону — г, Оксигену — г. Отже, реальні маси атомів є дуже малими, і є незручними у використанні.
Еталон порівняння було запропоновано Джоном Дальтоном — універсальна атомна одиниця маси (а. о. м.). Вона становить \(1/12\) частини маси атома Карбону.
У хімії прийнято використовувати відносні атомні маси.
Відносна атомна маса — це фізична величина, що визначається відношенням маси атома елемента до \(1\) а. о. м. Вона показує, у скільки раз маса даного атома більша за \(1/12\) маси атома Карбону.
\(1/12\) маси Карбону становить:
г.
Діленням справжніх мас атомів елементів на значення атомної одиниці маси одержують відносну атомну масу.
Зверни увагу!
Відносні атомні маси усіх елементів обчислені та внесені у Періодичну систему хімічних елементів. Графічним зображенням Періодичної системи є періодична таблиця хімічних елементів.