Атоми більшості хімічних елементів не можуть існувати поодинці.
Виняток становлять інертні елементи, які мають завершені зовнішні рівні:
Молекули цих елементів є одноатомними.
Атоми всіх інших елементів зв'язуються між собою і утворюють різні прості та складні речовини, число атомів в яких може змінюватися від двох до декількох тисяч. Атоми утримуються разом завдяки наявності хімічного зв'язку.
Хімічний зв'язок — це взаємодія, яка об'єднує атоми у складніші системи — молекули або кристали.
Причини утворення хімічного зв'язку:
1. Нестійкість атомів з незавершеним зовнішнім рівнем і прагнення до його заповнення.
2. Прагнення до мінімуму енергії.
За сучасними даними хімічний зв'язок визначається взаємодією позитивно заряджених ядер і негативно заряджених електронів.
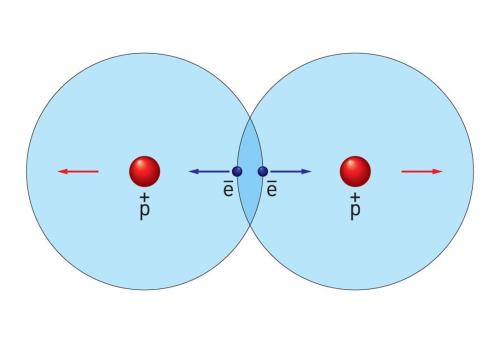
Сили відштовхування врівноважуються силами притягування і атоми утримуються разом. Таким чином виникає хімічний зв'язок.

Енергія створеної системи (молекули, кристала) нижче суми енергій вихідних атомів.
При утворенні хімічного зв'язку енергія завжди виділяється.
При утворенні зв'язку відбувається заповнення зовнішніх енергетичних рівнів. Атоми набувають електронну будову найближчого інертного елемента.
Для цього атоми неметалічних елементів приєднують електрони, щоб на зовнішньому рівні стало два (у Гідрогену) або вісім електронів (у всіх інших елементів).
Приклад:
В атомі Сульфуру на зовнішньому шарі розташовані шість електронів: \(2е\), \(8е\), \(6е.\)
\( \)До стабільного стану йому необхідно прийняти два електрони.
Отже, отримується будова інертного елемента Аргону \(2е\), \(8е\), \(8е\).
В атомі Карбону на зовнішньому шарі розташовані чотири електроні \(2е\), \(4е\).
До стабільного стану йому необхідно прийняти чотири електрони.
Отримується будова інертного елемента Неону \(2е\), \(8е\).
Зверни увагу!
Атоми металічних елементів віддають свої зовнішні електрони. При цьому зовнішнім стає заповнений рівень перед зовнішнім.
Приклад:
В атомі Літію на зовнішньому шарі міститься один електрон: \(2е, 1е.\)
До стабільного стану йому необхідно позбутися одного електрона.
Отримується будова інертного елемента Гелію \(2е\).
В атомі Кальцію на зовнішньому шарі містяться два електрони: \(2е, 8е, 8е, 2е\).
До стабільного стану йому необхідно віддати два електрони.
Отримується будова інертного елемента Аргону \(2е, 8е, 8е\).