Основні положення теорії електролітичної дисоціації
1. Під час розчинення у воді електроліти дисоціюють (розпадаються) на позитивно заряджені йони (катіони) і негативно заряджені йони (аніони).
2. Причиною дисоціації електроліту у водному розчині є його гідратація, тобто взаємодія електроліту з молекулами води і розрив хімічного зв'язку у ньому.
3. Електролітична дисоціація є зворотнім процесом для слабких електролітів. Поряд з процесом дисоціації (розпаду електроліту на йони) протікає і зворотний процес — асоціація (з'єднання йонів).
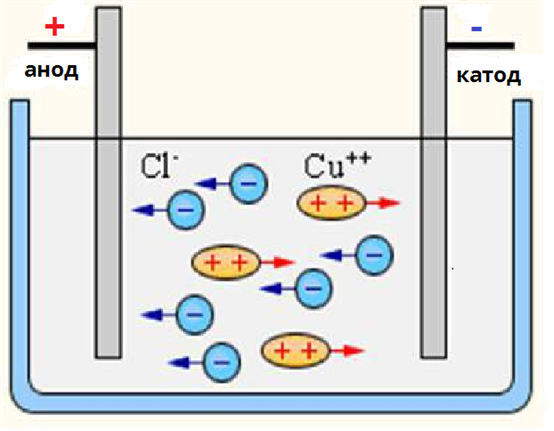
Якщо через розчин пропускати електричний струм, то позитивно заряджені йони (катіони) будуть рухатися у бік негативно зарядженого електрода — катода. Негативно заряджені йони (аніони) будуть рухатися у бік позитивно зарядженого елекрода — анода.