Розглянемо перший випадок, коли реакції йонного обміну протікають до кінця:
йони зв'язуються і утворюють нерозчинну речовину, яка випадає в осад.
Змішаємо розчини натрій сульфату і барій хлориду (див. рисунок).
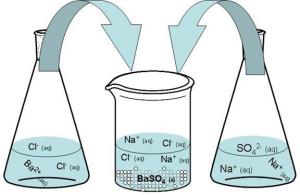
В результаті хімічної реакції випаде білий осад барій сульфату.
- Молекулярне рівняння реакції виглядає наступним чином:
.
Перепишемо це рівняння, зобразивши сильні електроліти у вигляді йонів, а нерозчинну речовину, що вийде зі сфери реакції — у молекулярному вигляді.
- Рівняння, що отримали — повне йонне рівняння реакції:
.
- Якщо виключити з обох частин рівності однакові йони, які не беруть участі у реакції, то вийде скорочене йонне рівняння реакції:
.
Скорочене йонне рівняння показує, що суть реакції зводиться до взаємодії йонів Барію і сульфат-іонів , у результаті чого утворюється осад барій сульфату .
Скорочене йонне рівняння характеризує сутність реакції, показує, які йони реагують між собою, і яку речовину вони утворюють у результаті йонної реакції.
При цьому неважливо, до складу яких речовин-електролітів входили ці йони до реакції. Це могли бути розчини сульфатної кислоти і барій нітрату, або амоній сульфату і барій хлориду, тощо. Скорочене йонне рівняння реакцій цих пар речовин матиме вигляд:
.
Таким чином, якщо у будь-яких водних розчинах електролітів містяться йони Барію і сульфат-іони, то вони завжди взаємодіють між собою, утворюючи білий осад барій сульфату.
Реакції, за допомогою яких можна виявити певний вид йонів (речовин) називаються якісними реакціями.