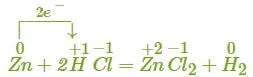Для того щоб визначити, чи є реакція окисно-відновною, потрібно:
- вказати ступінь окиснення усіх елементів у вихідних речовинах і продуктах реакції;
- порівняти ступені окиснення кожного елемента у вихідних речовинах і у продуктах.
Приклад:
визначимо, чи є реакція окисно-відновною:
.
Розставимо ступені окиснення:
.
Жоден з елементів не змінив ступінь окиснення. Отже, реакція не відноситься до окисно-відновних.
Розглянемо реакцію цинку з соляною кислотою:
.
Вкажемо ступені окиснення:
.
Змінилися ступені окиснення Цинку і Гідрогену, отже, реакція є окисно-відновною.
Знайдемо у реакції взаємодії цинку з хлоридною кислотою окисник і відновник, визначимо процеси відновлення і окиснення і число електронів, яке переміщається від відновника до окисника.
Приклад:
Складемо схеми окиснення і відновлення:
— окиснення;
відновник
— відновлення.
окисник
Електрони в реакціях не зникають і не з'являються. Тому число електронів, які віддає відновник, завжди дорівнює числу електронів, які приймає окисник. У реакції атом Цинку віддає \(2\) електрони двом атомам Гідрогену: