Хімічні властивості карбонових кислот обумовлені наявністю в їх складі карбоксильної групи .
Розчинні кислоти дисоціюють у воді на катіони Гідрогену і аніони кислотного залишку:
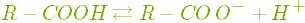 .
.Йони Гідрогену надають розчинам кислот кислий смак, а також спільні з неорганічними кислотами хімічні властивості.
Карбонові кислоти — слабкі електроліти і слабкі кислоти. Найсильніша з них, метанова, відноситься до кислот середньої сили. Зі збільшенням числа атомів Карбону в молекулі сила кислот зменшується.
У хімічних реакціях з багатьма речовинами утворюються солі карбонових кислот. Солі мурашиної кислоти — форміати (метаноати), солі оцтової кислоти — ацетати (етаноати).
Хімічні властивості етанової кислоти
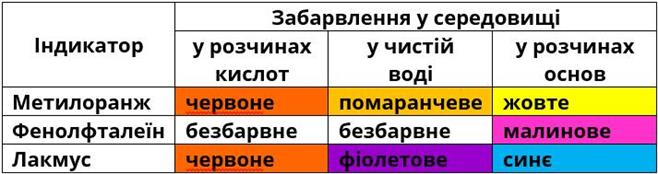
- Змінює забарвлення індикаторів.
Лакмус і метилоранж в розчині етанової кислоти стають червоними. Фенолфталеїн своє забарвлення не змінює, як і в розчинах неорганічних кислот.
- Взаємодіє з деякими металами () з виділенням водню і утворенням солей (етаноатів, або ацетатів):

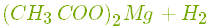 .
.
Цинк з оцтовою кислотою
- Реагує з основними оксидами з утворенням солі і води:

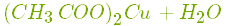 .
.
Купрум(\(II\)) оксид і етанова кислота
- Вступає у реакцію нейтралізації з основами:
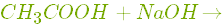
 .
.- Взаємодіє з карбонатами. Реакція відбувається з виділенням вуглекислого газу:

 .
.
Сода і оцет
