Білки (протеїни, поліпептиди) — найчисленніші, найбільш різноманітні біополімери, що мають першорядне значення для клітин. До складу молекул білків входять атоми Карбону, Гідрогену, Оксигену, Нітрогену, а і іноді Сульфуру, Фосфору і Феруму. Мономерами білків є амінокислоти, які (маючи у своєму складі карбоксильну та аміногрупи) мають властивості і кислоти, і основи, отже є амфотерними сполуками.
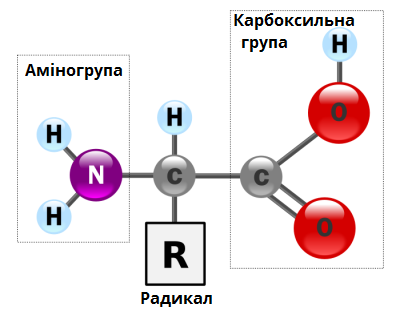
Завдяки цьому амінокислоти можуть сполучатися одна з одною (їх кількість в одній молекулі може досягати декількох сотень). У зв'язку з цим молекули білків мають великі розміри, і їх називають макромолекулами.

Структура білкової молекули
Під структурою білкової молекули розуміють її амінокислотний склад, послідовність мономерів і ступінь скрученности молекули білка.
У молекулах білків зустрічається всього \(20\) видів різних амінокислот, і величезна різноманітність білків утворюється за рахунок різного їх поєднання.
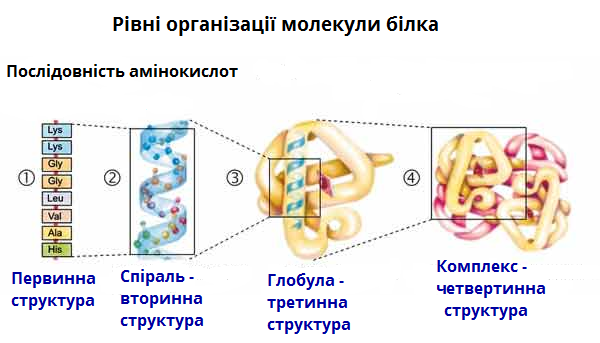
- Послідовність амінокислот у складі поліпептидного ланцюга — це первинна структура білка (вона є унікальною для будь-якого білка і визначає його форму, властивості і функції).
- Довга молекула білка згортається і набуває спочатку вигляд спіралі в результаті утворення водневих зв'язків між — \(СО\) та — \(NН\) групами різних амінокислотних залишків поліпептидного ланцюга (між Карбоном карбоксильної групи однієї амінокислоти і Нітрогеном аміногрупи іншої амінокислоти). Ця спіраль — вторинна структура білка.
- Третинна структура білка — тривимірна просторова «упаковка» поліпептидного ланцюга у вигляді глобули (кульки). Міцність третинної структури забезпечується різноманітними зв'язками, що виникають між радикалами амінокислот (гідрофобними, водневими, йонними і дисульфідними \(S\) — \(S\) зв'язками).
- Деякі білки (наприклад, гемоглобін крові людини) мають четвертинну структуру. Вона виникає у результаті сполучення декількох макромолекул з третинною структурою у складний комплекс. Четвертинна структура утримується неміцними йонними, водневими і гідрофобними зв'язками.
Структура білків може порушуватися (піддаватися денатурації) при нагріванні, обробці деякими хімічними речовинами, опроміненні, тощо. При слабкому впливі розпадається лише четвертинна структура, при сильнішому — третинна, потім — вторинна, і білок залишається у вигляді поліпептидного ланцюга. У результаті денатурації білок втрачає здатність виконувати свою функцію.
Порушення четвертинної, третинної і вторинної структур можна зупинити. Цей процес називають ренатурацією.
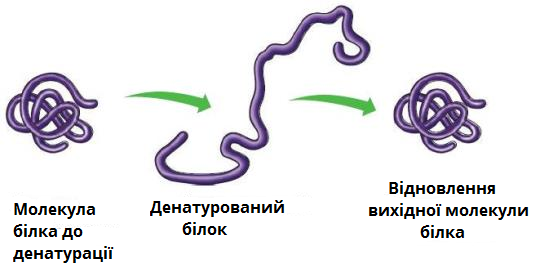
Руйнування первинної структури білка є незворотнім.
Крім простих білків, що складаються тільки з амінокислот, є ще й складні білки, до складу яких можуть входити вуглеводи (глікопротеїни), жири (ліпопротеїни), нуклеїнові кислоти (нуклеопротеїнами), тощо.